
【题目】全氮类物质具有高密度、超高能量及爆轰产物清洁无污染等优点。中国科学家成功合成全氮阴离子![]() ,
,![]() 是制备全氮类物质
是制备全氮类物质![]()
![]() 的重要中间体。下列说法中不正确的是
的重要中间体。下列说法中不正确的是
A.全氮类物质属于绿色能源B.每个![]() 中含有35个质子
中含有35个质子
C.![]()
![]() 结构中含共价键和离子键D.每个
结构中含共价键和离子键D.每个![]() 中含有35个电子
中含有35个电子
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】某课题组以苯为主要原料,采取以下路线合成利胆药——柳胺酚。
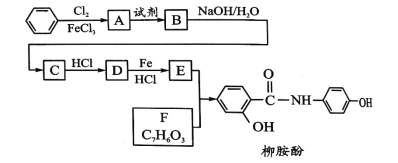
已知: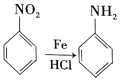
(1)对于柳胺酚,下列说法正确的是_____;
A.1mol柳胺酚最多可以和7molH2加成
B.不发生硝化反应
C.可发生消去反应
D.可与溴发生取代反应
(2)写出A→B反应所需的试剂_____;
(3)写出B→C的化学方程式______;
(4)写出化合物F的结构简式____;
(5)写出化合物E中官能团的的结构简式_____;
(6)写出同时符合下列条件的F的同分异构体的结构简式_____(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应(有醛基)
(7)以苯为原料合成苯胺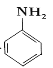 ,请设计合成路线(无机试剂及溶剂任选)_____。注:合成路线的书写格式参照如下示例流程图:CH3CHO
,请设计合成路线(无机试剂及溶剂任选)_____。注:合成路线的书写格式参照如下示例流程图:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 用排饱和氯化钠溶液的方法来收集氯气
B. 配制和保存硫酸铁溶液常加入适量稀硫酸
C. 向氢氧化镁悬浊液中加入饱和氯化铵溶液,溶液变澄清
D. 对2 HI (g)![]() H2 (g) + I2 (g)的平衡体系,增大压强使颜色变深
H2 (g) + I2 (g)的平衡体系,增大压强使颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种合成药物中间体X的结构简式如图所示。下列说法正确的是

A.X分子中不存在手性碳原子
B.一定条件下,X可以发生加聚反应
C.1 mol X跟足量浓溴水反应,最多消耗1 mol Br2
D.1 mol X跟足量NaOH溶液反应,最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将纯Fe棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是( )

A.M连接电源负极,N连接电源正极,如果把烧杯中的溶液换成1LCuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀
B.M连接电源正极,N连接电源负极,将C电极换成Cu电极,电解质溶液换成硫酸铜溶液,则可实现在铁上镀铜
C.M连接电源正极,N连接电源负极,当两极产生气体总量为22.4mL(标准状况)时,则生成0.001molNaOH
D.去掉电源,将M、N用导线直接相连,在溶液中滴入酚酞试液,C电极周围溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子数依次增加,由这些元素组成的常见物质的转化关系如图所示,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质能与沸水反应,且该单质可制造照明弹,f为固体单质。下列有关说法正确的是

A.简单离子半径:Y>Z>X
B.元素的非金属性:W>X
C.X、Y两种元素组成的化合物只含离子键
D.最高价氧化物对应水化物的碱性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )

A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.a点溶液中存在如下关系:c(Na+) + c(H+) = c(ClO-)+ c(OH-)+ c(ClO3-)
C.b点溶液中各离子浓度:c(Na+) > c(Cl-) > c(ClO-) = c(ClO3-)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2ClO-= Cl-+ ClO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将HA和HB两种一元酸的溶液分别加水稀释,稀释时溶液pH的变化如图所示。以下叙述中不正确的是
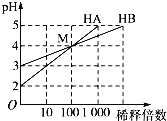
A.HB是一种弱酸
B.稀释前,![]()
C.在NaB和HB的混合溶液中一定存在:![]()
D.在M点的两种溶液中:![]() ,且
,且![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com