
| A. | 在已知元素中具有最大的原子半径 | B. | 在空气中燃烧时生成氧化物Fr2O | ||
| C. | 氧化物对应的水化物是极强的碱 | D. | 其单质的熔点比金属钠的熔点低 |
分析 A.同一周期,原子半径随着原子序数增大而减小,同一主族元素原子半径随着原子序数增大而增大;
B.碱金属族元素从Na开始,在空气中燃烧生成过氧化物,Fr金属性大于Na,其生成的氧化物更复杂;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强;
D.碱金属族元素,其单质的熔沸点随着原子序数增大而降低.
解答 解:A.同一周期,原子半径随着原子序数增大而减小,同一主族元素原子半径随着原子序数增大而增大,所以在元素周期表中原子半径最大的元素位于周期表左下角,所以Fr在已知元素中具有最大的原子半径,故A正确;
B.碱金属族元素从Na开始,在空气中燃烧生成过氧化物,Fr金属性大于Na,其生成的氧化物更复杂,还生成超氧化物等,故B错误;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Fr>Na,NaOH是强碱,则FrOH也是强碱,故C正确;
D.碱金属族元素,其单质的熔沸点随着原子序数增大而降低,原子序数Fr>Na,则其单质的熔点比金属钠的熔点低,故D正确;
故选B.
点评 本题考查元素周期律,为高频考点,明确同一主族元素结构和性质递变规律是解本题关键,注意规律中的异常现象,易错选项是B.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:实验题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
 (4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
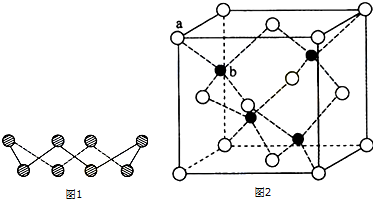
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O | |
| B. | 用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁:Mg(OH)2+2NH4+=Mg2++2NH3•H2O | |
| C. | 向1mol明矾的水溶液当中加入氢氧化钡,当沉淀的质量最大时离子方程式科表示为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| D. | 酸性高锰酸钾和过氧化氢制取少量氧气:4MnO4-+4H2O2+12H+=4Mn 2++7O2↓+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用燃烧法鉴别乙醇、苯 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
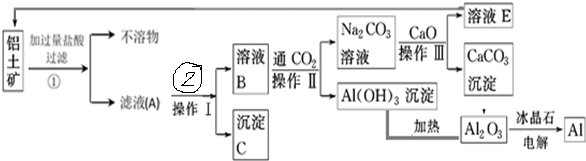
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解可以得到氯乙烯 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 所有烷烃和蛋白质中都存在碳碳单键 | |
| D. | 蔗糖和麦芽糖的组成都是C12H22O11,水解产物均含有葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com