
分析 (1)标准状况下2.24L氯气的物质的量为0.1mol,亚铁离子的还原性大于溴离子,氯气不足时亚铁离子优先反应,0.1mol亚铁离子完全反应消耗0.05mol氯气,剩余的0.05mol氯气还能够氧化0.1mol溴离子,据此写出反应的离子方程式;
(2)向Ca(HCO3)2溶液中加入过量NaOH溶液,反应生成碳酸钙沉淀、碳酸钠和水;
(3)二氧化硫少量,反应生成亚硫酸铵.
解答 解:(1)标准状况下,2.24L氯气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,0.1molFeBr2中含有0.1mol亚铁离子、0.2mol溴离子,亚铁离子还原性较强,优先被氧化,0.1mol亚铁离子完全反应消耗0.05mol氯气,还剩余的0.05mol氯气能够氧化0.1mol溴离子,说明只有一半的溴离子被氧化,反应的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,
故答案为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;
(2)向Ca(HCO3)2溶液中加入过量NaOH溶液,反应生成碳酸钙、碳酸钠和水,反应的离子反应为:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O,
故答案为:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O;
(3)向氨水中通入少量SO2,反应生成亚硫酸铵,反应的离子反应为:2NH3•H2O+SO2═2NH4++SO32-+H2O,
故答案为:2NH3•H2O+SO2═2NH4++SO32-+H2O.
点评 本题考查了离子方程式的书写,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,如难溶物、弱电解质等需要保留化学式,必须满足守恒关系(如:质量守恒和电荷守恒等)等,(1)为易错点,注意正确判断反应物过量情况及反应先后顺序.


科目:高中化学 来源: 题型:解答题
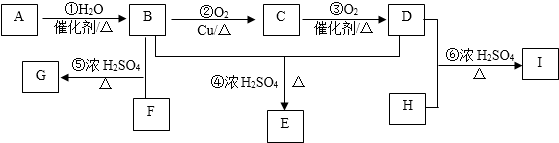
 .
.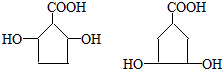 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
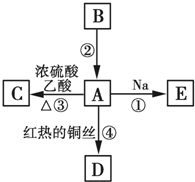 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示: CH3COOC2H5+H2O
CH3COOC2H5+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
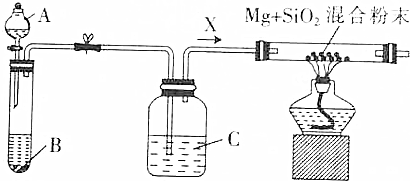
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在已知元素中具有最大的原子半径 | B. | 在空气中燃烧时生成氧化物Fr2O | ||
| C. | 氧化物对应的水化物是极强的碱 | D. | 其单质的熔点比金属钠的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
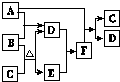 有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系: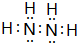 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
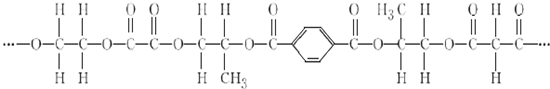
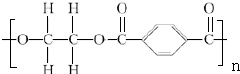 +2nH2O.
+2nH2O.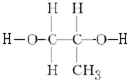 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com