
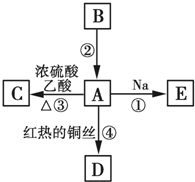
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示: CH3COOC2H5+H2O
CH3COOC2H5+H2O分析 B的产量可衡量一个国家石油化工发展的水平,B是CH2=CH2,A是化学实验室中常见的有机物,它易溶于水并有特殊香味,A能与Na、乙酸反应,在红热铜丝发生催化氧化,可推知A是CH3CH2OH,C是CH3COOC2H5,D是CH3CHO,E是CH3CH2ONa,据此解答.
解答 解:B的产量可衡量一个国家石油化工发展的水平,B是CH2=CH2,A是化学实验室中常见的有机物,它易溶于水并有特殊香味,A能与Na、乙酸反应,在红热铜丝发生催化氧化,可推知A是CH3CH2OH,C是CH3COOC2H5,D是CH3CHO,E是CH3CH2ONa.
(1)B的结构简式为CH2=CH2,A是CH3CH2OH,A中官能团的名称为:羟基,
故答案为:CH2=CH2;羟基;
(2)验证有机物乙酸中含有-COOH所用的试剂是:Na2CO3溶液(或石蕊溶液),实验现象是:产生气泡(或变红),
故答案为:Na2CO3溶液(或石蕊溶液);产生气泡(或变红);
(3)反应①的化学方程式:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,
反应③的化学方程式:CH3COOH+C2H5OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
反应④的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;CH3COOH+C2H5OH CH3COOC2H5+H2O;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
CH3COOC2H5+H2O;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)反应②是乙烯与水发生加成反应生成乙醇,反应③是乙酸与乙醇发生酯化反应生成乙酸乙酯,
故答案为:加成反应;酯化反应.
点评 本题考查有机的推断,涉及烯、醇、羧酸的性质与转化等,难度不大,是对常见有机物知识的简单运用,注意掌握各类有机物的性质.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 洗净的容量瓶中残留少量的蒸馏水 | B. | 溶解NaOH的烧杯未洗净 | ||
| C. | 称量NaOH时使用称量纸 | D. | 定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- | |
| B. | 中性溶液中:Fe3+、MnO4-、SO42-、K+ | |
| C. | 酸性溶液中:Na+、ClO-、SO42-、I- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 |
| 金刚石:3550 | Li:181 | HF:-83 | NaCl:801 |
| 硅晶体:1410 | Na:98 | HCl:-115 | KCl:776 |
| 硼晶体:2300 | K:64 | HBr:-89 | RbCl:718 |
| 二氧化硅:1723 | Rb:39 | HI:-51 | CaCl:645 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双氧水最主要的用途是漂白和杀菌消毒,在环境保护、化学合成和工业生产中有着广泛的应用.查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,如图所示.
双氧水最主要的用途是漂白和杀菌消毒,在环境保护、化学合成和工业生产中有着广泛的应用.查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com