
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
分析 由电子守恒:n(Co3+)=2 n(Cl2),计算出可计算出原氧化物中含有的n(Co3+);0.2mol Co5O6中含有Co原子的总物质的量为:0.2mol×5=1mol,则原化合物中+2价Co的物质的量=1mol-n(Co3+),据此进行解答.
解答 解:由电子守恒可得,原0.2mol Co5O6中含有Co3+的物质的量为:n(Co3+)=2 n(Cl2)=2×$\frac{4.48L}{22.4L/mol}$=0.4 mol,
0.2mol Co5O6中含有Co原子的总物质的量为:0.2mol×5=1mol,
则原化合物中+2价Co的物质的量为:n(Co2+)=1mol-0.4mol=0.6mol,
故选C.
点评 本题考查了氧化还原反应的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握电子守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
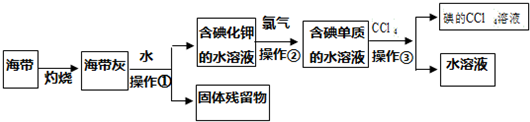
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双氧水最主要的用途是漂白和杀菌消毒,在环境保护、化学合成和工业生产中有着广泛的应用.查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,如图所示.
双氧水最主要的用途是漂白和杀菌消毒,在环境保护、化学合成和工业生产中有着广泛的应用.查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
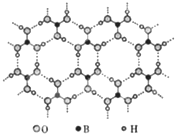 正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )
正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )| A. | 正硼酸晶体属于分子晶体 | B. | H3BO3分子的稳定性与氢键有关 | ||
| C. | 分子中硼原子最外层不是8e-结构 | D. | 含1mol H3BO3的晶体中有3mol氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入KI溶液振荡 | |
| B. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓HNO3和浓H2SO4,将其倒入NaOH溶液中振荡,静置,分液 | |
| D. | 乙烯中混有SO2和CO2,将其通入酸性KMnO4溶液中洗气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com