
| A. | 溴苯中混有溴,加入KI溶液振荡 | |
| B. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓HNO3和浓H2SO4,将其倒入NaOH溶液中振荡,静置,分液 | |
| D. | 乙烯中混有SO2和CO2,将其通入酸性KMnO4溶液中洗气 |
分析 A.生成的碘易溶于溴苯;
B.易引入新杂质氢气;
C.酸与NaOH反应后,与硝基苯分层;
D.乙烯、二氧化硫均与高锰酸钾反应.
解答 解:A.Br2与KI溶液反应生成碘单质,碘单质与溴苯仍是互溶体系,不能分离,应选NaOH溶液、分液,故A错误;
B.利用氢气与乙烯发生加成反应,除去乙烯,但会引入氢气,且反应条件复杂,难以实现,应选溴水、洗气除杂,故B错误;
C.浓硝酸和浓硫酸可与氢氧化钠反应,而硝基苯不反应,且不溶于水,可用氢氧化钠溶液、静置,分液来除杂,故C正确;
D.CO2、SO2可与NaOH溶液发生反应,而乙烯不反应,可除杂,但乙烯能与酸性高锰酸钾发生氧化还原反应生成二氧化碳气体,不能除杂,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应及混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意除杂的原则及有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
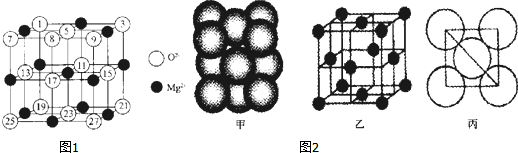
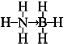 ;与氨硼烷互为等电子体的有机小分子是CH3CH3 (写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3 (写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑥ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步骤 | 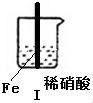 |  | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2═2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 | |
| D. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡需要加热的反应一定是吸热反应 | |
| B. | 反应物的总能量不一定比生成物的总能量高 | |
| C. | 化学反应速率的大小主要取决于反应进行时的外界因素 | |
| D. | 催化剂都能加大化学反应速率,并提高原料的利用率和转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大幅度降低能耗 | |
| B. | 电解时铁在阴极上析出 | |
| C. | 降低温室气体的排放 | |
| D. | 生成等量的铁时,此方法与热还原法转移的电子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com