已知T1时反应H2(g)+I2(g) 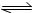 2HI(g) ; △H=-9.4 kJ/mol
2HI(g) ; △H=-9.4 kJ/mol
(1)T1时,将2 mol HI(g)通入容积为2L的容器中发生上述反应,测得T1温度时各物质的物质的量随时间的变化关系如下表:
| | t(min)
(1)①0.056 mol/(L ·min)(3分) ②K= c(HI)2/[c(H2) · c(I2)] (3分) ③D (3分) (2)AD(全对计4分,只有一个答案且正确2分)
练习册系列答案
相关习题
科目:高中化学
来源:
题型:
 (2009?清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N 2(g)+3H 2(g)?2NH 3(g) 已知298K时:△H=-92.4kJ?mol -1试回答下列问题: (1)在298K时,将10mol N 2和30mol H 2放入合成塔中,为何放出的热量小于924kJ? 该反应为可逆反应,10molN2和30molH2不可能完全反应,所以放出的热量小于10×10×92.4kJ=924kJ 该反应为可逆反应,10molN2和30molH2不可能完全反应,所以放出的热量小于10×10×92.4kJ=924kJ . (2)如图一在一定条件下,将1mol N 2与3mol H 2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答: ①N 2的转化率α A为 40% 40% . ②在状态A时,平衡常数K A= (代入数值的表达式,不写出具体数值)当温度由T 1变化到T 2时,K A> > K B(填“>”、“<”或“=”) (3)图二是实验室模拟工业法合成氨的简易装置.简述检验有氨气生成的方法 用湿润的红色石蕊试纸放在导管口处,若试纸变蓝,说明有氨气生成 用湿润的红色石蕊试纸放在导管口处,若试纸变蓝,说明有氨气生成 .在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H +),实现了高温常压下高转化率的电化学合成氨.其实验装置如图.阴极的电极反应式 N2+6e-+6H+=2NH3 N2+6e-+6H+=2NH3 .
查看答案和解析>>
科目:高中化学
来源:
题型:阅读理解
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义. (1)硫酸生产中,SO 2催化氧化生成SO 3:2SO 2(g)+O 2(g)?2SO 3(g),混合体系中SO 3的质量分数和温度的关系如图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:  ①2SO 2(g)+O 2(g)?2SO 3(g)的△H < < 0(选填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 向左 向左 移动(选填“向左”、“向右”或“不”); ②若温度为T 1、T 2,反应的平衡常数分别为K 1、K 2,则K 1> > K 2;若反应进行到状态D时,v 正> > v 逆(选填“>”、“<”或“=”). (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用. ①图2是一定的温度和压强下N 2和H 2反应生成1mol NH 3过程中能量变化示意图,请写出合成氨的热化学反应方程式: N2(g)+3H2(g)?2NH3(g); N2(g)+3H2(g)?2NH3(g); 、 △H=2(a-b)kJ?mol-1 △H=2(a-b)kJ?mol-1 .(△H的数值用含字母a、b的代数式表示,不必注明反应条件) ②氨气溶于水得到氨水.在25℃下,将xmol?L -1的氨水与ymol?L -1的盐酸等体积混合,所得溶液呈中性.则x > > y,所得溶液中c(NH 4+) = = C(Cl -)(选填“>”、“<”或“=”);用含x和y的代数式表示出一水合氨的电离平衡常数 . (3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.在25℃下,向0.1mol?L -1的NaCl溶液中逐滴加入适量的0.1mol?L -1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol?L -1的NaI溶液,看到的现象是 白色沉淀转化为黄色沉淀 白色沉淀转化为黄色沉淀 ,产生该现象的原因是(用离子方程式表示) AgCl(s)+I-(aq)=AgI(s)+Cl-(aq) AgCl(s)+I-(aq)=AgI(s)+Cl-(aq) .(已知25℃时K sp[AgCl]=1.0×10 -10 mol 2?L -2,Ksp[AgI]=1.5×10 -16mol 2?L -2)
查看答案和解析>>
科目:高中化学
来源:
题型:
用(A)、“>”、(B)“<”(C)“=”填空. (1)同温同压下,H 2(g)+Cl 2(g)=2HCl(g),光照和点燃条件的△H(化学计量数相同分别为△H 1、 △H 2,则△H 1 △H 2; (2)相同条件下,2mol氢原子所具有的能量 1mol氢分子所具有的能量; (3)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H 1 △H 2. ①4P(白磷,s)+5O 2(g)=2P 2O 5(s)△H 1, ②4P(红磷,s)+5O 2(g)=2P 2O 5(s)△H 2; (4)已知:在稀溶液中,H +(aq)+OH -(aq)=H 2O(l)△H=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应生成1mol液态水,放出的热量 57.3kJ; (5)可逆反应:aA(气)+bB(气)?cC(气)+dD(气);△H=-QkJ/mol,根据图回答:  ①P 1 P 2;②(a+b) (c+d); ③t 1℃ t 2℃; ④Q 0.
查看答案和解析>>
科目:高中化学
来源:2010年湖南省高考适应性测试(理综)化学部分
题型:填空题
(13分)
已知T1时反应H2(g)+I2(g) 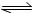 2HI(g) ; △H=-9.4 kJ/mol 2HI(g) ; △H=-9.4 kJ/mol
(1)T1时,将2 mol HI(g)通入容积为2L的容器中发生上述反应,测得T1温度时各物质的物质的量随时间的变化关系如下表:
  物质 物质
| 0
| 2
| 4
| 6
| 8
| 10
| H2
| 0
| 0.174
| 0.224
| 0.244
| 0.244
| 0.244
| I2
| 0
| 0.174
| 0.224
| 0.244
| 0.244
| 0.244
| HI
| 2
| 1.652
| 1.552
| 1.512
| 1.512
| 1.512
|
①前4 min,用HI(g)表示该反应的平均速率为 ; ②T 1温度下,此反应H 2(g)+I 2(g) 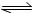 2HI(g) 的平衡常数表达式为 ; ③10分钟后,要使HI的转化率变为10%,可能的操作是 ; A.扩大容积 B.同时减少三种物质各0.01 mol C.加入HI(g) 1 mol D.降低温度 (2)如图,将2 mol HI(g)和2 molBr 2(g)分别通入用光滑的滑动隔板隔离的同一容器的两边。加热容器升温至T 2 ,反应足够长时间后,有关说法正确的是 。 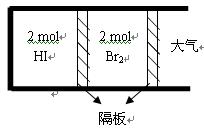 A.两边气体体积相同 B.两边气体颜色均比加热前变深 C.两边气体的平均相对分子质量均比加热前大 D.两边气体密度均比加热前减小
查看答案和解析>>
| | |

![]() 2HI(g) ; △H=-9.4 kJ/mol
2HI(g) ; △H=-9.4 kJ/mol