
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 铝是一种活泼金属 | 室外冶炼少量铝可用铝热反应 |
| B | CuS极难溶于水 | 用硫酸铜溶液除去电石气中的H2S |
| C | 二氧化硫具有还原性 | 可用二氧化硫漂白纸浆、草帽等 |
| D | 碳酸氢钠能与碱反应 | 常用碳酸氢钠做糕点膨松剂 |
| A、A | B、B | C、C | D、D |


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
| A、56g铁片投入足量冷的浓硝酸中,转移3NA个电子 |
| B、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| C、1molNa2O2固体中含离子总数为4NA |
| D、常温常压下,22.4L氟化氢中含有氟原子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,22.4LNO2含有2NA 个氧原子 |
| B、0.1mol?L-1的NaNO3溶液中含有0.1NA 个NO3- |
| C、常温下,34gNH3含有6NA 个N-H共价键 |
| D、1mol Fe2+与足量的Cl2反应,转移2NA 个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、氢氧化钡与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| C、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、碳酸钠与石灰水反应:Ca2++CO32-?=CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2g | B、2.8g |
| C、5.6g | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
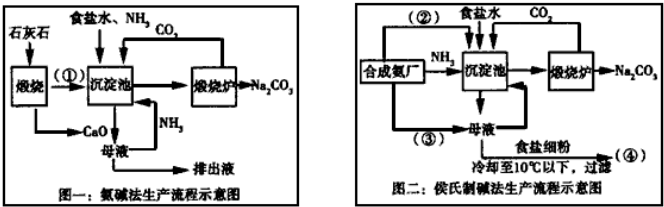
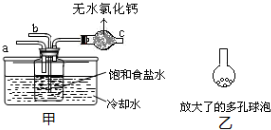
查看答案和解析>>
科目:高中化学 来源: 题型:
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| c(CH3COOH) |
| c(CH3COO-) |
c(HC
| ||
c(C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.12L氧气 |
| B、1.12L氢气 |
| C、2.24L氢气 |
| D、2.24L氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com