
【题目】萃取碘水中的碘,可用的萃取剂是①四氯化碳 ②汽油 ③苯 ④酒精( )
A.只有①B.①和④C.①②③D.①②④
科目:高中化学 来源: 题型:
【题目】(NH4)2SO4是一种常见的化肥,某工厂用石膏、NH3、H2O和CO2制备(NH4)2SO4的工艺流程如下:

下列说法正确的是
A. 通入NH3和CO2的顺序可以互换
B. 操作2为将滤液加热浓缩、冷却结晶、过滤,可得(NH4)2SO4
C. 步骤②中反应的离子方程式为Ca2++2NH3+CO2+H2O=CaCO3↓+2NH4+
D. 通入的NH2和CO2均应过量,且工艺流程中CO2可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向![]() 镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体
镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体![]() 。向反应后的溶液中加入
。向反应后的溶液中加入![]() 氢氧化钠溶液
氢氧化钠溶液![]() ,使金属离子刚好沉淀完全,得到的沉淀质量为
,使金属离子刚好沉淀完全,得到的沉淀质量为![]() 。再将得到的沉淀灼烧至质量不再改变为止。得到固体
。再将得到的沉淀灼烧至质量不再改变为止。得到固体![]() 。则下列关系不正确的是
。则下列关系不正确的是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铝化合物在生活生产中有广泛应用。
(1)自然界中存在的54Fe和56Fe,它们互称为_____。
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因_____。
(3)已知明矾可以净水,明矾化学式_____,试结合离子反应方程式与文字解释明矾净水的原因_____
(4)以NaAlO2溶液、AlCl3溶液、氨水、CO2气体为原料,选择合适试剂,写出实验室制备Al(OH)3的离 子方程式:(任意两条途径)_____、_____
(5)达喜是常用的中和胃酸的药物,其化学成分是铝和镁的碱式盐,化学式为Al2Mg6(OH)16CO3·4H2O【可看做2Al(OH)3·5Mg(OH)2·MgCO3·4H2O】。1mol达喜分别与足量的盐酸和 NaOH 溶液反应,消耗盐酸和 NaOH 的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
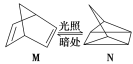 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家发现了一种新分子,它具有空心的类似足球的结构,分子式为C60,下列说法正确的是
A.C60是一种新型的化合物
B.C60和石墨都是碳的同素异形体
C.C60中虽然没有离子键,但固体为离子晶体
D.C60相对分子质量为360
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分类不正确的是( )
A.纯碱、烧碱均属于碱类
B.CO2、SiO2、SO2均属于酸性氧化物
C.醋酸、硫酸、硝酸均属于酸类
D.Na2CO3、Na2SO3、NaCl均属于钠盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO3·3H2O2) 在洗涤、纺织、医药等领域有广泛应用。一种制备过碳酸钠的工艺流程如图所示。
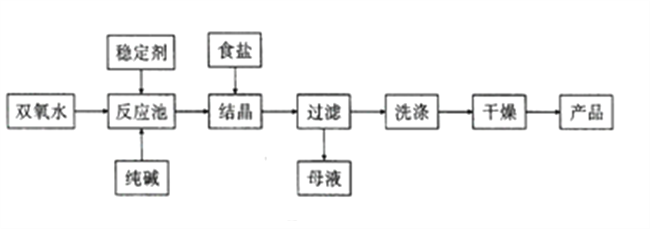
(1)碳酸钠水溶液呈碱性的原因是____________(用离子方程式表示),为增强洗涤效果,可采取最简单的措施是________________。
(2)过碳酸钠受热易分解,写出反应的化学方程式:__________________
(3)稳定剂可能是_____(填序号)。
A.Na2SO3 B.Na2SiO3 C.H2SO4 D.MnO2
(4)结晶时加入食盐的目的是_________,母液中可循环使用的物质是_________(填化学式)。
(5)工业上常以过碳酸钠产品中活性含氧量![]() 来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________(用代数式表示)。
来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com