
【题目】NiSO4是化学镀镍的原料,一种用废雷尼镍催化剂(已预处理,主要含NiO,还含有少量Fe、Cr及不溶物)制备NiSO4·7H2O的工艺流程如下:

回答下列问题:
(1)化学镀镍总反应为6NaOH+2NiSO4+NaH2PO2=2Ni+Na3PO4+2Na2SO4+4H2O,每生成1 mol Ni,转移电子的物质的量为____。
(2)“溶解”时,在反应器中加入湿料及水,为节约能耗,且维持反应始终在一定温度下进行,应进行的操作是________。
(3)“氧化”时,Fe2+被氧化的离子方程式为________。
(4)“滤渣2”的成分是______。
已知在实验条件下,几种离子开始沉淀和沉淀完全的pH如下表所示:
Ni2+ | Fe2+ | Cr3+ | Fe3+ | |
开始沉淀pH | 6.2 | 7.6 | 4.5 | 2.3 |
沉淀完全pH | 8.6 | 9.1 | 5.6 | 3.3 |
(5)“浓缩”时,加入H2SO4调节pH为3.5~4.0的目的是____;由浓缩液得到产品的步骤为____。
(6)测定产品镍的质量分数[w(Ni)]的实验步骤如下:准确称取0.1000 g产品于250 mL锥形瓶内,加入25 mL水、0.5 g氟化钠、10 mL氨性缓冲溶液、约0.1 g紫脲酸铵指示剂,摇匀,用0.0250 mol·L-1 EDTA滴定至试液呈紫红色为终点(Ni2++H2Y2-=NiY2-+2H+),消耗EDTA溶液14.00 mL,则产品中w(Ni)=____%。
【答案】2 mol 分次加入浓硫酸 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O Fe(OH)3和Cr(OH)3 抑制Ni2+的水解 冷却结晶、过滤、洗涤、干燥 20.65
【解析】
该流程的主要目的是制备制备NiSO4·7H2O,而原料中有多种杂质,流程主要围绕除杂质分析,废镍催化剂(主要含NiO,还含有少量Fe、Cr及不溶物),加入硫酸酸溶、过滤,滤渣为不溶性杂质,滤液加入NaClO溶液氧化,将亚铁离子氧化为三价铁离子,再加入氢氧化镍调节溶液的pH,生成Fe(OH)3和Cr(OH)3,过滤,滤渣II为Fe(OH)3和Cr(OH)3,得到的滤液为硫酸镍溶液,浓缩液中加入硫酸抑制水解,经冷却结晶得到晶体,以此解答该题。
(1)反应6NaOH+2NiSO4+NaH2PO2=2Ni+Na3PO4+2Na2SO4+4H2O中,镍元素从+2价降低到0价,磷元素从+3价升高到+5价,每生成2mol镍,转移4mol电子,当生成1 mol Ni,转移电子的物质的量为2mol,故答案为:2 mol;
(2)“溶解”时,要加入浓硫酸,要维持反应始终在一定温度下进行,应分次加入浓硫酸,避免放热过多导致温度升高,故答案为:分次加入浓硫酸;
(3)“氧化”时,Fe2+被次氯酸根氧化成Fe3+的,而次氯酸根被还原为氯离子,离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,故答案为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(4)加入氢氧化镍调到 5.6<pH<6.2 ,使Fe3+ 和Cr3+变为Fe(OH)3和Cr(OH)3 ,而Ni2+ 没有开始沉淀,再过滤,“滤渣2”的成分是Fe(OH)3和Cr(OH)3,故答案为:Fe(OH)3和Cr(OH)3;
(5)加入H2SO4调节pH为3.5~4.0的目的是创造酸性条件,抑制Ni2+的水解,防止生成氢氧化镍沉淀,由硫酸镍溶液得到晶体的方法为冷却结晶、过滤、洗涤、干燥,故答案为:抑制Ni2+的水解;冷却结晶、过滤、洗涤、干燥;
(6)消耗H2Y2-的物质的量=0.014L×0.0250molL-1=0.00035mol,由关系式:Ni2+~H2Y2-,可知镍元素的物质的量=0.000035mol,镍元素质量分数=![]() ×100%=20.65%,故答案为:20.65%。
×100%=20.65%,故答案为:20.65%。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中A、B属于盐,C属于碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为___。
(2)A溶液与B溶液反应可生成气体,则该反应的离子方程式为___。
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为___,鉴别溶液中B的阴离子的试剂为___。
②D溶于稀硝酸的离子方程式为___。
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为VL,则E在混合物中的质量分数的表达式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如下图所示的变化。

则:①写出下列物质的化学式:
丙__________,B____________,C__________, D____________。
②写出甲跟乙反应的化学方程式:__________________________。
③单质丙与溶液乙反应生成气体B的离子方程式:___________________。
(2)如图是各物质的反应关系图:已知A和E都是黄色粉末,F有刺激性气味且有漂白性。请据此回答下列问题:

写出图中编号的化学方程式:
①_______________________;
②_______________________;
③______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出):
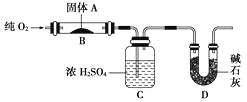
取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是______________________________________________。
(2)C装置的作用是__________________________________________;
D装置的作用是_____________________________________________。
(3)通过该实验,能否确定A中是否含有氧原子?________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.99 g,D装置增重26.4 g,则A分子式为____________。
(5)写出A燃烧的化学方程式_____________________________________。
(6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(物质结构与性质)元素周期表中第57号元素镧到71号元素镥这15种元素统称为镧系元素。回答下列问题:
(1)钬(Ho)可用来制作磁性材料,其基态原子电子排布式为[Xe]4f116s2,钬(Ho)有___个未成对电子。
(2)钇钡铜氧(YBa2Cu3O7-x)是一种高温超导材料(其中Y显+3价,Cu显+2、+3价),该材料所含元素中,电负性最大的元素是______(填元素符号),若YBa2Cu3O7-x材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=_____。
(3)下表是几种镧系元素的电离能(单位:kJ·mol-1)
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | |
Ce | 527 | 1047 | 1949 | 3547 |
La | 538 | 1067 | 1850 | 4819 |
Lu | 532 | 1340 | 2022 | 4370 |
Yb | 604 | 1174 | 2417 | 4203 |
据此,判断形成+3价化合物最稳定的元素是____(填元素符号)。
(4)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为____,1 mol CH2=CH2中含有的σ键数目为_______;常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是_____。
(5)从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的结构如图。
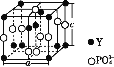
该磷钇矿的化学式为____,与PO43-互为等电子体的阴离子有____(写出两种离子的化学式)。已知晶胞参数a=0.69 nm,c=0.60 nm,阿伏加德罗常数为NA,则晶胞的密度为____g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:
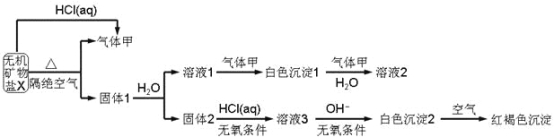
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。

(1)物质A的化学式为 ________。
(2)H在潮湿空气中变成M的实验现象是______________________________________,化学方程式为___________________________________________。
(3)A和水反应生成B和C的离子方程式为___________________________________,由此反应可知A有作为_________的用途。
(4)步骤①的离子方程式_______________________________________,请写出检验步骤①得到的溶液中主要阳离子(除H+外)所需要的试剂:_____________、____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应:![]() ,
,![]() ,向
,向![]() 、
、![]() 混合溶液中通入适量
混合溶液中通入适量![]() ,溶液中某些离子的物质的量变化如图所示。下列说法不正确的( )
,溶液中某些离子的物质的量变化如图所示。下列说法不正确的( )
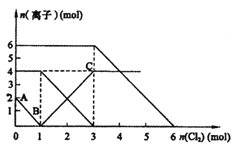
A.通过上述反应,比较还原性强弱![]()
B.原混合液中![]()
C.原混合液中![]()
D.通入![]() 时,溶液中发生的离子反应方程式为
时,溶液中发生的离子反应方程式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com