

解析:HCl气体在水中的溶解度很大且是一种酸性气体,可以直接用水吸收,也可用碱石灰吸收,两种方法都可保护环境,B装置不符合这一要求,可以排除在外。用水吸收时必须注意防止倒吸,即要考虑实验安全。比较A、F装置,直接将导管插入水中会产生倒吸,倒置漏斗吸收法能够防止倒吸,A可行、F不可行;进一步分析、比较一下装置C、D、G,气体都是从导管直接导入水中,当然容易出现倒吸,但D装置从反应装置中导出的玻璃管插入圆底烧瓶的上部,即使水倒吸到圆底烧瓶中,也不致于又将水倒吸入反应装置中,而C、G装置做不到这一点;再分析E装置,从反应装置中出来的气体导入管没有直接插入水中,中间的瓶起到缓冲作用,能够实现要求。
答案:ADEH


科目:高中化学 来源: 题型:阅读理解
 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动.实验方案如下:
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动.实验方案如下:| 1 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) | ||||
| i | 150 |
|
0.1 | ||||
| ii | 150 150 |
|
5 | ||||
| iii | 350 |
|
5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.| 同浓度溶液 | SO32- | HSO3- | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面 少 少 |
较上面 多 多 |
较上面 多 多 |
慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
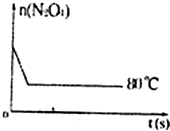


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com