
【题目】下图是一些含氯产品。

(1)储氯钢瓶中应贴的标签为_________(填字母代号)。
A.易燃品 B.有毒品 C.爆炸品
(2)“威猛先生”使用注意事项中特别说明在使用时切勿与漂白剂一同使用,否则会产生有害气体。“84”消毒液的有效成分是次氯酸钠,写出“84”消毒液与“威猛先生”(有效成分为盐酸)混合后反应的离子方程式_______。
(3)漂白粉的有效成分是_______(填化学式),老师新买的漂白粉没有保存说明书,请你为漂白粉设计一份保存注意事项,并用化学用语解释设计原因。
注意事项(不超过30个字):_________________。
解释(用化学用语):___________________。
【答案】 B Cl-+ ClO-+ 2H+ = Cl2↑+ H2O Ca(ClO)2 密封避光在干燥地方保存,避免受潮与酸性物质接触 Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO (2分)2HClO![]() 2HCl + O2↑
2HCl + O2↑
【解析】(1)氯气有毒,储氯钢瓶中应贴的标签为有毒品,答案选B。(2)次氯酸钠具有强氧化性,与盐酸反应生成氯气、水和氯化钠,反应的离子方程式为Cl-+ClO-+2H+=Cl2↑+H2O;(3)漂白粉的有效成分是Ca(ClO)2,漂白粉容易吸收空气中的水蒸气和二氧化碳生成次氯酸,次氯酸见光易分解,反应的方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+HClO、2HClO![]() 2HCl+O2↑,所以保存的注意事项是密封避光在干燥地方保存,避免受潮与酸性物质接触。
2HCl+O2↑,所以保存的注意事项是密封避光在干燥地方保存,避免受潮与酸性物质接触。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去.某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:在溶液中 KIO3+5KI+3H2SO4═3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目 , 该反应中还原产物与氧化产物的物质的量比是 , 0.2mol KIO3参加反应时转移电子mol
(2)实验结束后分离I2和K2SO4溶液所用的试剂是 ,
A.CCl4 B.酒精 C.Na2SO4溶液 D.食盐水
所用的分离方法是 , 所用主要玻璃仪器是
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4mL,配制中需要用到的主要玻璃仪器是(填序号) .
A.100mL量筒 B.托盘天平 C.玻璃棒 D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知原子序数,可能推断原子的
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
⑥原子结构示意图 ⑦元素在周期表中的位置
A. ①②③④⑥ B. ①④⑤⑥⑦
C. ②③④⑤⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )
A.使用Cu﹣Zn﹣Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数值.下列说法正确的是( )
A.1L0.1mol/L的NaHCO3溶液中HCO3﹣和CO3 2﹣离子数之和为0.1NA
B.标准状况下,22.4LC2H4与C3H6混合气体所含有分子数为NA
C.1molNa2O2与足量的CO2反应转移的电子数为2NA
D.18gNH4+所含的电子数11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组只领取了以下实验用品:铁架台、铁圈、铁夹、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。只使用上述仪器,不能进行的实验操作是( )
A. 蒸发 B. 萃取 C. 过滤 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,CH3COOH和NH3H2O的电离常数相等.
(1)25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3. ①将上述(1)溶液加水稀释至1000mL,溶液pH数值范围为 , 溶液中 ![]() (填“增大”“减小”“不变”或“不能确定”).
(填“增大”“减小”“不变”或“不能确定”).
②25℃时,0.1mol/L氨水(NH3H2O溶液)的pH= . 用pH试纸测定该氨水pH的操作方法为 .
③氨水(NH3H2O溶液)电离平衡常数表达式Kb= , 25℃时,氨水电离平衡常数约为 .
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中 ![]() (填序号). a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(填序号). a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
当加入CH3COOH溶液体积为10mL时,混合溶液的pH7(填“>”“=”“<”).
(3)某温度下,向V1mL0.1mol/LNaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图.已知:pOH=﹣lgc(OH﹣). 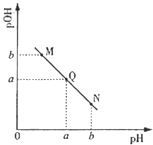
①图中M,Q,N三点所示溶液中水的电离程度最大的是(填字母).
②若Q点时滴加醋酸溶液体积为V2 mL,则V1V2(填“>”“=”“<”).
③若在曲线上某一点W时加入醋酸的体积为V1 mL,则W点应位于图中曲线上Q点的(填“上方”“下方”),此时溶液中离子浓度由大到小的顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:
2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.
(1)上述反应中氧化剂是 .
(2)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,你认为必须选用的物质有 (填序号).
(3)某厂废液中,含有2%~5%的NaNO2 , 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 .
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式
Al+ NaNO3+ NaOH═ NaAlO2+ N2↑+ H2O
若反应过程中转移5mol 电子,则生成标准状况下N2的体积为 L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com