
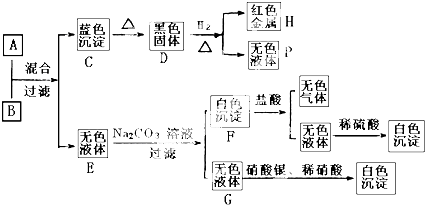
| ||
 ,故答案为:
,故答案为: ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
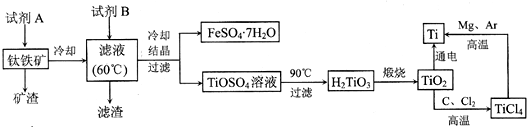
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
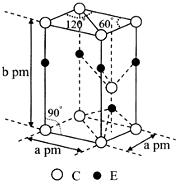 前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对.
前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用托盘天平准确称取3.15gNaCl |
| B、实验室中可用燃烧法处理CO、H2、H2S等可燃性尾气 |
| C、测定中和热时,环形玻璃搅拌棒可用铜丝代替或直接用温度计搅拌 |
| D、Fe2+与Fe[(CN)6]3-反应生成Fe3[Fe(CN)6]2蓝色沉淀,该反应可用于Fe2+的检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
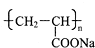 )具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )
)具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )| A、聚丙烯酸钠属于混合物 |
| B、聚丙烯酸钠属于天然有机高分子化合物 |
| C、聚丙烯酸钠可用于生产“尿不湿” |
| D、路面喷洒聚丙烯酸钠溶液能抑制扬尘,一定程度上能预防雾霾和PM2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水泥、玻璃、陶瓷都是硅酸盐产品,均属于无机非金属材料 |
| B、明矾、漂白粉、臭氧都可作净水剂,其净水原理相同 |
| C、蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
| D、绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
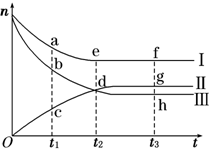 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,28 g氮气所含的原子数为2NA |
| B、22.4 L甲烷(CH4)所含的原子数为5NA |
| C、0.5 molCuO的摩尔质量为40g/mol |
| D、2L 1mol?L-1K2SO4溶液中离子的总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com