
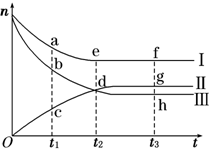
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.| 92.2KJ |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH>7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+) |
| B、0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b |
| C、0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)] |
| D、已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2溶于水可以导电,说明SO2是电解质 |
| B、电解质本身可以导电,也可以不导电 |
| C、强电解质与弱电解质的差别就是溶液导电性不同 |
| D、物质的量浓度相同的NaOH溶液与氨水,氨水的pH值较小,说明氨水是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
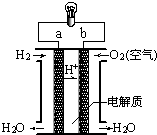
| A、a极是负极 |
| B、正极的电极反应是:O2+2H2O+4e-═4OH- |
| C、电子由a通过灯泡流向b |
| D、氢氧燃料电池是环保电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2与CO2 |
| B、Na与O2 |
| C、NaOH与CO2 |
| D、Fe与HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同周期金属元素的最外层电子越多,其原子失电子能力越强 |
| B、对于HF、HCl、HBr其熔、沸点随其相对分子质量的增大而升高 |
| C、ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| D、同主族元素的简单阴离子还原性越强,其盐类的水解程度越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com