
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、水泥、玻璃、陶瓷都是硅酸盐产品,均属于无机非金属材料 |
| B、明矾、漂白粉、臭氧都可作净水剂,其净水原理相同 |
| C、蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
| D、绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
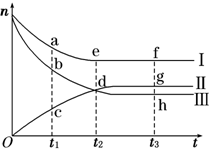 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向明矾溶液中加入足量的氢氧化钡溶液Ba2++4OH-+Al3++SO42-=BaSO4↓+AlO2-+2H2O |
| B、酸性高锰酸钾溶液与草酸溶液混合2MnO4-+5C2O42-+16H+=2Mn2++10 CO2↑+8H2O |
| C、将等物质的量浓度的氯水与FeI2溶液混合2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl- |
| D、向氢氧化钡溶液中通入足量的SO2气体OH-+SO2=HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com