
| ||
| ||


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
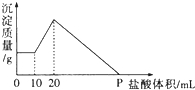 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求:
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH2═CH2+H2O→CH3CH2OH | |||
B、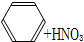
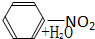 | |||
C、CH3COOH+HOCH2CH3
| |||
D、CH3CH2Cl+H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2[CuO] |
| B、NaOH[Na2O] |
| C、NaCl[HCl] |
| D、CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH>7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+) |
| B、0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b |
| C、0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)] |
| D、已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度有利于反应速率增加,从而缩短达到平衡的时间升高温度 |
| B、正向反应速率增加,逆向反应速率减小 |
| C、达到平衡后,升高温度,平衡向正反应方向移动 |
| D、达到平衡后,减小压强,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量铁粉与稀硝酸反应:Fe+4H++NO3-=Fe3++2H2O+NO↑ |
| B、将少量SO2气体通入NaClO溶液中:SO2+ClO-+H2O=SO32-+2HClO |
| C、硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-=BaSO4+H2O |
| D、向Mg(OH)2浊液中滴入FeCl3溶液:3 Mg(OH)2(s)+2 Fe3+?2 Fe(OH)3(s)+3Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com