
| A、足量铁粉与稀硝酸反应:Fe+4H++NO3-=Fe3++2H2O+NO↑ |
| B、将少量SO2气体通入NaClO溶液中:SO2+ClO-+H2O=SO32-+2HClO |
| C、硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-=BaSO4+H2O |
| D、向Mg(OH)2浊液中滴入FeCl3溶液:3 Mg(OH)2(s)+2 Fe3+?2 Fe(OH)3(s)+3Mg2+ |


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:W>Y>Z>M>X |
| B、化合物甲中可能含有离子键和共价键 |
| C、由W元素形成的单质在自然界的贮量丰富,并存在大量的单质 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl- |
| B、切开的金属Na暴露在空气中,光亮表面逐渐变暗4Na+O2=2Na2O |
| C、Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2 |
| D、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
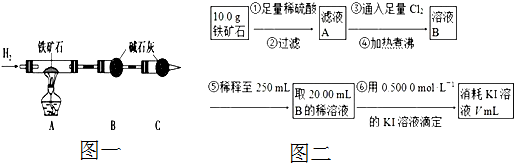
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com