
【题目】A、B、C三种短周期元素,它们的原子序数依次增大。A元素原子的核外p电子数比s电子数少1,B元素原子核外有4种能级,且全部充满电子;C元素的主族序数与周期数的差为4。
(1)A的基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(2)某同学推断B基态原子的核外电子排布为![]() ,该同学所画的电子排布图违背了_____________。
,该同学所画的电子排布图违背了_____________。
(3)C位于______族_____区,价电子排布式为_________。
【答案】3 哑铃 泡利原理 ⅦA p 3s23p5
【解析】
A、B、C三种短周期元素,它们的原子序数依次增大。A元素原子的核外p电子数比s电子数少1,A原子的核外电子排布式为1s22s22p3,A为N元素,B元素原子核外有4种能级,且全部充满电子,B原子的核外电子排布式为1s22s22p63s2,B为Mg元素;C元素的主族序数与周期数的差为4,C为Cl元素。
(1)A为N元素,原子的核外电子排布式为1s22s22p3,A的基态原子中能量最高的电子2p能级的3个电子,其电子云在空间有x、y、z的3个方向,p能级原子轨道呈哑铃形。
故答案为:3; 哑铃;
(2)B为Mg元素,某同学推断B基态原子的核外电子排布为![]() ,3s轨道中的2个电子自旋方向不能相同,应为:
,3s轨道中的2个电子自旋方向不能相同,应为: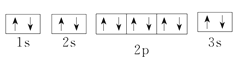 ,该同学所画的电子排布图违背了泡利原理。
,该同学所画的电子排布图违背了泡利原理。
故答案为:泡利原理;
(3)C为Cl元素,位于第三周期ⅦA族p区,价电子排布式为3s23p5。
故答案为:ⅦA ; p; 3s23p5。


科目:高中化学 来源: 题型:
【题目】(1)①写出“海洋元素”的元素符号_____________,②写出钡餐的化学式:_____________。
(2)镁失火时不能用二氧化碳灭火,用化学方程式表示其原因_____________。
(3)《新修本草》有云:“青矾( FeSO4·7H2O)本来绿色,新出窟未见风者,正如瑁璃…烧之赤色…。”根据以上信息,写出“青矾”受热分解的化学方程式_____________。
(4)双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:_____________MnO4ˉ+_____________H2O2+_____________=_____________Mn2++_____________H2O+_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烯烃、炔烃、苯的同系物、醇等有机物的叙述中正确的是( )
A.![]() 甲基
甲基![]() ,
,![]() 己二醇根据羟基数目分类应该属于二元醇
己二醇根据羟基数目分类应该属于二元醇
B.在苯的某种同系物中加入少量酸性高锰酸钾溶液振荡后溶液褪色是苯环和侧链相互影响的结果
C.![]() 分子结构中6个碳原子可能都在一条直线上
分子结构中6个碳原子可能都在一条直线上
D.![]() 月桂烯的结构如图所示
月桂烯的结构如图所示![]()
![]()
![]() ,该物质与等物质的量溴发生加成反应的产物
,该物质与等物质的量溴发生加成反应的产物![]() 不考虑立体异构
不考虑立体异构![]() 理论上最多有4种
理论上最多有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料E和含扑热息痛高分子药物的合成流程如下图所示:
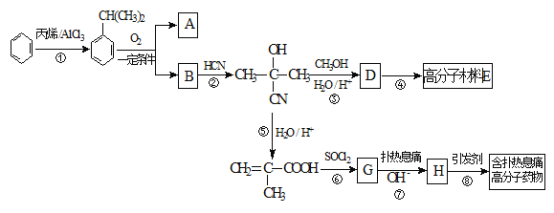
已知:I.含扑热息痛高分子药物的结构为: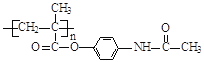 。
。
II.![]()
III.![]()
试回答下列问题:
(1)①的反应类型为____________,G的分子式为____________。
(2)若1 mol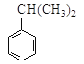 可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
(3)反应②为加成反应,则B的结构简式为__________;扑热息痛的结构简式为______________。
(4)写出含扑热息痛高分子药物与足量氢氧化钠溶液发生反应的化学方程式____________________。
(5)D蒸气密度是相同状态下甲烷密度的6.25倍,D中各元素的质量分数分别为碳60%,氢8%,氧32% 。D有多种同分异构体,其中属于链状酯类,且能发生银镜反应的同分异构体有_______种(考虑顺反异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA (气) ![]() bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质A的质量分数增加了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molM和2 molN置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g)![]() P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )

A. 若X、Y两点的平衡常数分别为K1、K2,则K1>K2
B. 温度为T1时,N的平衡转化率为80%,平衡常数K=40
C. 无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态
D. 降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
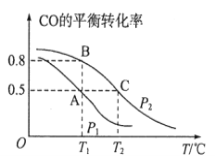
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是__________________。
③下列叙述能说明上述反应能达到化学平衡状态的是__________________(填代号) 。
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=__________________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大,不变或减小”)。
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol。此时v(正)________v(逆)(填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2与我们的生活息息相关,低浓度SO2废气的处理是工业难题,目前常用的一种处理方法如下
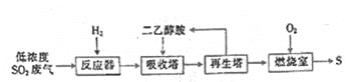
已知:反应器中发生反应3H2+SO2=H2S+2H2O。
下列有关说法不正确的是( )
A.SO2是有毒气体,能形成酸雨破坏环境,不能用作食品的防腐剂
B.二乙醇胺的作用是吸收H2S,且可以循环使用
C.再生塔中加热分解重新获得H2S,主要目的是富集H2S
D.理论上燃烧室中的O2可以用SO2代替
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com