
【题目】下列解释事实的反应方程式不正确的是( )
A. 热的纯碱溶液可去除油污:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-2e-=Fe2+
C. 以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2++S2-=CuS↓
D. 向电解饱和食盐水的两极溶液中滴加酚酞,阴极变红:2H2O+2e-==H2↑+2OH-
【答案】A
【解析】
A. 热的纯碱溶液水解显碱性,可去除油污,碳酸根离子水解分两步,不能合并,离子方程式为:CO32-+2H2O![]() HCO3-+OH-,故错误;
HCO3-+OH-,故错误;
B. 钢铁发生吸氧腐蚀时,铁作负极被氧化失去电子生成亚铁离子,离子方程式:Fe-2e-=Fe2+,故正确;
C. 以Na2S为沉淀剂,除去溶液中的Cu2+,因为铜离子和硫离子反应生成硫化铜沉淀,离子方程式为:Cu2++S2-=CuS↓,故正确;
D. 电解饱和食盐水时阳极是溶液中的阴离子即氢氧根离子反应生成氧气,阴极是溶液中的氢离子反应生成氢气,两极溶液中滴加酚酞,阴极氢离子反应后溶液中的氢氧根离子浓度增大,显碱性,溶液变红,电极反应为:2H2O+2e-==H2↑+2OH-,故正确。
故选A。


科目:高中化学 来源: 题型:
【题目】新材料的研制与应用始终是科技发展的主要方向之一。
(1)某太阳能吸热涂层以镍或镍合金空心球为吸收剂,基态镍原子的价层电子排布式是____。
(2)硼及其化合物广泛应用于永磁材料、超导材料等领域,硼可以与氟气反应生成BF3气体,BF3分子的立体构型为___________。
(3)石墨的晶体结构如图所示,如图虚线勾勒出的是其晶胞。则石墨晶胞含碳原了个数___________。碳的两种同素异形体中键长较短的是___________(填“石墨”或“金钢石”)。

(4)石墨烯(图甲〕是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)

图乙中,1号C的杂化方式是___________,该C与相邻C形成的键角___________(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
(5)有机太阳能固体电池材料含有高纯度C60,其分子结构如图,1molC分子中π键的数目为___________。C60能溶于二硫化碳而不溶于水的原因是___________。C60的晶胞与干冰的晶胞相似,已知该晶胞的密度为ρg·cm-3,则两个最近C60分子间的距离为___________nm(列出计算式,已知阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示不正确的是
A.体积:④<①<②<③B.密度:①<④<③<②
C.质量:④<①<③<②D.氢原子数:②<④<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是( )
A. 加入催化剂有利于合成氨的反应
B. 由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深
C. 500 ℃时比室温更有利于合成氨的反应
D. 将混合气体中的氨液化有利于合成氨反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产环氧乙烷(![]() )的反应为:2 CH2=CH2(g) +O2(g)
)的反应为:2 CH2=CH2(g) +O2(g)![]() 2
2![]() (g) ΔH=-106 kJ·mol-1,其反应机理如下:①Ag+O2
(g) ΔH=-106 kJ·mol-1,其反应机理如下:①Ag+O2![]() AgO2 慢
AgO2 慢
②CH2=CH2+AgO2![]()
![]() +AgO 快
+AgO 快
③CH2=CH2+6AgO![]() 2CO2+2H2O+6Ag 快
2CO2+2H2O+6Ag 快
下列有关该反应的说法正确的是
A. 反应的活化能等于106 kJ·mol-1
B. AgO2也是反应的催化剂
C. 增大乙烯浓度能显著提高环氧乙烷的生成速率
D. 理论上0.7 mol乙烯参与反应最多可得到0.6 mol环氧乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是
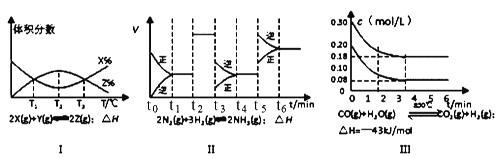
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B. 由图Ⅱ知,反应在t6时,NH3体积分数最大
C. 由图Ⅱ知,t3时采取的措施是降低反应体系温度
D. Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外价电子排布式为____________,基态镁原子核外电子有____________种不同的空间运动状态。
(2)钛存在两种同素异形体,α—Ti采纳六方最密堆积,β—Ti采纳体心立方堆积,由α—Ti转变为β—Ti晶体体积____________(填“膨胀”或“收缩”)。
(3)写出与NH4+互为等电子体的一种分子和一种离子的化学式____________、____________。
(4)丙烯腈(CH2=CH-CN)分子中![]() 键和π键的个数比为____________,分子中碳原子轨道杂化类型是____________。
键和π键的个数比为____________,分子中碳原子轨道杂化类型是____________。
(5)请写出H、C、N、O元素电负性由大到小的顺序____________。
(6)金属Na的熔点、沸点都比金属Mg低的原因是________________________。
(7)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为___________,若阿伏加德罗常数值为NA,晶胞的边长为apm,该晶体的密度为___________g·cm-3.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数K的说法中,正确的是
A. 在任何条件下,化学平衡常数是一个恒定值
B. 平衡常数K只与温度有关,与反应浓度、压强无关
C. 平衡常数K不仅与温度有关,也与反应浓度、压强有关
D. 对于可逆反应C(s)+H2O(g) ![]() CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式为
CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. HClO电离 HClO=ClO-+H+
B. CuSO4水解 Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
C. NaHCO3电离 NaHCO3![]() Na++HCO3-
Na++HCO3-
D. KF水解 Fˉ+H2O![]() HF+OHˉ
HF+OHˉ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com