
| (0.5b-2a)mol |
| V×10-3L |
| 1000(0.5b-2a) |
| V |
| 1000(0.5b-2a) |
| V |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、②③④ |
| C、③⑤⑥ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol |
| B、0.2 mol |
| C、0.05 mol |
| D、0.025 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉是纯净物,漂白液是混合物 |
| B、漂白粉的有效成分是Ca(ClO)2 |
| C、工业上将氯气通入澄清石灰水制取漂白粉 |
| D、漂白液的有效成分是Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
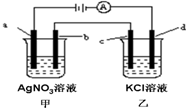 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A、乙烧杯中的d电极反应式为Fe-2e-=Fe2+ |
| B、当电解一段时间后,将甲、乙两溶液混合,一定会沉淀 |
| C、当b极增重5.4g时,d极产生的气体为2.24L(标准状况) |
| D、甲烧杯中溶液的pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应速率增大 |
| B、逆反应速率先减小后增大 |
| C、达到平衡时,逆反应速率比原平衡要大 |
| D、CO的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1?min-1 |
| B、0.2mol?L-1?min-1 |
| C、0.9mol?L-1?min-1 |
| D、1.0mol?L-1?min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com