

| A、T1和T2的关系是:T1>T2 |
| B、Kw的关系是:B>C>A=D=E |
| C、A点到D点:加入少量酸可实现 |
| D、T2时:pH=2的硫酸与pH=12的NaOH溶液等体枳混合,溶液呈中性 |


科目:高中化学 来源: 题型:
 ,下列关于该有机物的说法正确的是( )
,下列关于该有机物的说法正确的是( )| A、其分子式为C13H18O |
| B、能发生加成反应、取代反应、水解反应 |
| C、属于芳香族化合物 |
| D、能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
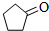 )可由环戊烷经三步反应合成:
)可由环戊烷经三步反应合成: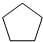
| 反应1 |
| 反应2 |
| 反应3 |
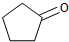
| A、反应1可用试剂是氯气 |
| B、反应3可用的试剂是氧气和铜 |
| C、反应1为取代反应,反应2为消去反应 |
| D、A可通过加成反应合成Y |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率(×10-3mol.min-1 | 7.34 | 3.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 mL 0.4mol/L的盐酸 |
| B、10 mL 0.3mol/L MgCl2溶液 |
| C、10 mL 0.5mol/LNaCl溶液 |
| D、10 mL 0.1mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOH与HCN均为弱酸,酸性:HCN>CH3COOH |
| B、25℃时,水电离出来的c(H+)均为 10-11mol/L的两种酸,酸的浓度:HCN>CH3COOH |
| C、25℃时,浓度均为0.1 mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa>NaCN |
| D、25℃时,pH均为3的CH3COOH与HCN溶液各100ml与等浓度的NaOH溶液反应,消耗NaOH溶液体积:CH3COOH>HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:
 -定条件下,在绝热恒容2L密闭容器中进行反应N2(g)+3H2(g)?2NH3(g)△H<0,若反应过程中n(H2)和n(NH3)随时间变化的关系如图所示,则下列有关叙述中一定正确的是( )
-定条件下,在绝热恒容2L密闭容器中进行反应N2(g)+3H2(g)?2NH3(g)△H<0,若反应过程中n(H2)和n(NH3)随时间变化的关系如图所示,则下列有关叙述中一定正确的是( )| A、若在t2时刻再充入一定量He,达平衡时c(H2)<0.4mol/L |
| B、a点表示NH3生成速率与NH3分解速率相等 |
| C、b点和c点H2的转化率相等 |
| D、若在t2时刻再充入一定量He,达平衡时化学平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用二氧化碳制造全降解塑料,可以减缓二氧化碳对环境的影响 |
| B、淀粉、油脂、蛋白质都能在人体内水解,也能在体内氧化提供能量 |
| C、CO2与SiO2都是ⅣA族元素的氧化物,但它们的物理性质特别是在熔沸点、硬度上相差很大,这是由于它们的化学键类型不同造成的 |
| D、酸碱质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱.根据这一理论,Al(OH)3、NaHCO3都是酸碱两性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用足量的KMnO4溶液吸收SO2气体:2MnO4+5SO2+2H2O=2Mn2-+5SO42-+4H+ | ||||
| B、Ca(ClO)2溶液与Na2SO3溶液混合:Ca2++SO32-=CaSO3↓ | ||||
C、NH4HSO3溶液与足量NaOH溶液共热:NH4++2OH-
| ||||
D、已知H2的燃烧热△H=-285.8kj?mol-1,则用热化学方程式可表示为:H2(g)+
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com