
| A. | 气体的摩尔体积约为22.4L•mol-1 | |
| B. | 在标准状况下,1mol任何物质所占的体积都约为22.4L | |
| C. | HNO3的摩尔质量是63g | |
| D. | 硫酸和磷酸的摩尔质量相等,都是98g/mol |
分析 A.温度、压强影响气体摩尔体积;
B.在标准状况下,1mol任何气体物质所占的体积都约为22.4L,物质并不都是气体;
C.HNO3的摩尔质量是63g/mol;
D.摩尔质量以g/mol为单位,数值上等于其相对分子质量.
解答 解:A.标况下气体的摩尔体积约为22.4L•mol-1,由于温度、压强影响气体摩尔体积,故不同状态下下气体的摩尔体积不一定为22.4L•mol-1,故A错误;
B.在标准状况下,1mol任何气体物质所占的体积都约为22.4L,物质并不都是气体,故B错误;
C.1mol HNO3的质量是63g,HNO3的摩尔质量是63g/mol,故C错误;
D.硫酸和磷酸的相对分子质量均为98,二者摩尔质量都是98g/mol,故D正确,
故选:D.
点评 本题考查气体摩尔体积、摩尔质量,比较基础,注意根据PV=NRT理解温度、压强对气体摩尔体积的影响.


科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 172.5 kJ/mol | B. | -172.5 kJ/mol | C. | 393.5 kJ/mol | D. | -393.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2MH3(g)△H=-38.6kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H=38.6kJ•mol-1 | |
| D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既不能使炉火瞬间更旺,又不能节省燃料 | |
| B. | 虽不能使炉火瞬间更旺,但可以节省燃料 | |
| C. | 既能使炉火瞬间更旺又可以节省燃料 | |
| D. | 不能节省燃料,但能使炉火瞬间更旺 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.
向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
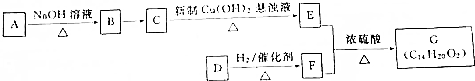
 或
或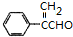 .
.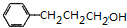 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$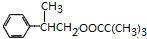 +H2O或(CH3)3CCOOH+
+H2O或(CH3)3CCOOH+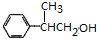 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$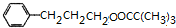 +H2O.
+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝中加入过量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝与盐酸反应:2Al(OH)3+6H+═2Al3++6H20 | |
| C. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 偏铝酸钠溶液与适量稀硝酸反应:AlO2-+H++H20═Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com