

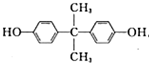
 ,G是一种高分子,可用于制造隐形眼镜的材料.H为六元环酯.
,G是一种高分子,可用于制造隐形眼镜的材料.H为六元环酯. .
. .
. .
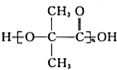
.
分析 根据题中各物质转化关系,D在浓硫酸作用下生成E或H,H为六元环酯,根据E的结构可知,H为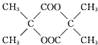 ,所以D为
,所以D为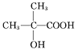 ,A在碱性条件下水解再酸化得D和B,根据B的结构结合A的分子式可知,A为
,A在碱性条件下水解再酸化得D和B,根据B的结构结合A的分子式可知,A为 ,B与足量的溴水发生取代反应生成C为
,B与足量的溴水发生取代反应生成C为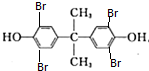 ,E与乙二醇发生酯化反应得F为
,E与乙二醇发生酯化反应得F为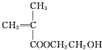 ,F发生加聚反应得高分子G为
,F发生加聚反应得高分子G为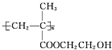 ,据此答题;
,据此答题;



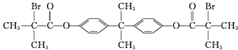
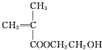


解答 解:根据题中各物质转化关系,D在浓硫酸作用下生成E或H,H为六元环酯,根据E的结构可知,H为 ,所以D为
,所以D为 ,A在碱性条件下水解再酸化得D和B,根据B的结构结合A的分子式可知,A为
,A在碱性条件下水解再酸化得D和B,根据B的结构结合A的分子式可知,A为 ,B与足量的溴水发生取代反应生成C为
,B与足量的溴水发生取代反应生成C为 ,E与乙二醇发生酯化反应得F为
,E与乙二醇发生酯化反应得F为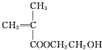 ,F发生加聚反应得高分子G为
,F发生加聚反应得高分子G为 ,
,
(1)根据E的结构简式可知,E中含有的官能团名称为碳碳双键、羧基,D为 ,D的系统命名法为2-甲基-2-羟基丙酸,
,D的系统命名法为2-甲基-2-羟基丙酸,
故答案为:碳碳双键、羧基;2-甲基-2-羟基丙酸;
(2)根据上面的分析可知,B→C的反应类型为取代反应,A的结构简式为 ,
,
故答案为:取代反应; ;
;
(3)F→G的化学方程式为 ,
,
故答案为: ;
;
(4)根据条件①可发生银镜反应,说明有醛基,②能与NaOH溶液发生水解反应说明有酯基,③结构中不含甲基,结合E的结构可知E的同分异构体为 ,
,
故答案为: ;
;
(5)A.B中有两个酚羟基,所以与苯酚不属于同系物,故A错误;
B.根据B的结构可知,B苯环上的一溴代物有2种,故B正确;
C.D为 ,D可在浓硫酸、加热条件下发生缩聚反应生成
,D可在浓硫酸、加热条件下发生缩聚反应生成 ,故C正确;
,故C正确;
D.A为 ,1molA最多可与6molNaOH发生反应,故D错误,
,1molA最多可与6molNaOH发生反应,故D错误,
故选AD.
点评 本题考查有机物的推断及合成,同时考查学生知识迁移能力,利用题给信息进行分析解答,明确有机物的官能团及性质是解本题关键,难度较大.


科目:高中化学 来源: 题型:选择题
| a | |||
| b | |||
| c | d | ||
| e |
| A. | 元素b位于ⅥA族,有+6、-2两种常见化合价 | |
| B. | 五种元素中,元素e的性质最稳定 | |
| C. | 原子半径有d>c>b | |
| D. | 元素e的化合物可能有剧毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度为0.1mol•L-1 CH3COOH溶液,加水稀释,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 浓度为0.1mol•L-1 CH3COOH溶液,升高温度,Ka (CH3COOH)不变,但醋酸的电离程度增大 | |
| C. | 在稀AgNO3溶液中先加入过量0.1mol/L NaCl溶液,再加入少量0.1mol/L Na2S溶液,先产生白色沉淀,后出现黑色沉淀,说明Ksp(AgCl)>Ksp(Ag2S) | |
| D. | 在恒容密闭容器中,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0达到平衡后,使用高效催化剂,正反应速率增加,逆反应速率减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A,B,C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如图所示关系.写出符合如图关系的A,B,C的化学式,(1)~(3)中的A不在同一主族.
A,B,C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如图所示关系.写出符合如图关系的A,B,C的化学式,(1)~(3)中的A不在同一主族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸混合:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 少量SO2通入到漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 往明矾溶液中加入氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2 Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于2cmol/L | B. | 小于2cmol/L | ||
| C. | 等于2cmol/L | D. | 在cmol/L和2cmol/L之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 )的废水可以利用微生物电池除去,其原理如图2所示.
)的废水可以利用微生物电池除去,其原理如图2所示. +2e-+H+═
+2e-+H+═ +Cl-.
+Cl-.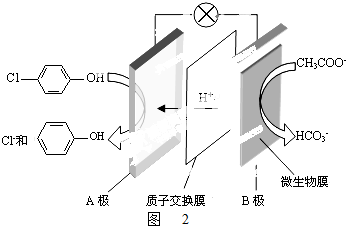
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com