
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大。A原子的最外层电子数是次外层电子数的2倍,C的氢化物在常温下为液体,D能形成DF型离子化合物,0.9 g E与足量的稀硫酸反应生成的氢气在标准状况下的体积为1.12 L,F的族序数与周期序数之差为4。请回答下列问题:
(1)写出元素符号:A________;B________; F________。
(2)六种元素中,单质还原性最强的是______(写化学式,下同);最高价氧化物对应水化物中酸性最强的酸是______。
(3)写出C与D形成的原子个数比为1:1的化合物的电子式:______所含化学键类型为______。
(4)六种元素中的三种元素组成的某种盐的水溶液呈碱性,是家用消毒剂的主要成分,请用离子方程式解释该盐溶液呈碱性的原因:_________________________。
(5)D、E元素的最高价氧化物对应的水化物发生反应的离子方程式为__________。
(6)写出用惰性电极电解饱和DF溶液的化学方程式:________________________。
【答案】 C N Cl Na HClO4 过氧化钠 离子键、共价键 ClO-+H2O====HClO+OH- Al(OH)3+OH-=====AlO2-+2H2O 2NaCl+2H2O=====2NaOH+H2+Cl2
【解析】A、B、C、D、E、F六种短周期元素,其原子序数依次增大。A原子的最外层电子数是次外层电子数的2倍,A为C元素;C的氢化物在常温下为液体,C为O元素,则B为N元素;D能形成DF型离子化合物,F的族序数与周期序数之差为4,则F为Cl元素,D为Na元素。0.9 g E与足量的稀硫酸反应生成的氢气在标准状况下的体积为1.12 L,即生成0.05mol,则E转移1mol电子的质量为![]() =9g,则E为Al元素。
=9g,则E为Al元素。
(1)个根据上述分析,A为C元素;B为N元素;F为Cl元素,故答案为:C;N;Cl;
(2)六种元素中,单质还原性最强的是钠;最高价氧化物对应水化物中酸性最强的酸是高氯酸,故答案为:Na;HClO4;
(3)C与D形成的原子个数比为1:1的化合物是过氧化钠,电子式为![]() ,所含化学键类型有离子键、共价键,故答案为:
,所含化学键类型有离子键、共价键,故答案为:![]() ;离子键、共价键;
;离子键、共价键;
(4)六种元素中的三种元素组成的某种盐的水溶液呈碱性,是家用消毒剂的主要成分,该物质为次氯酸钠,水解显碱性,水解的离子方程式为ClO-+H2O=HClO+OH-,故答案为:ClO-+H2O=HClO+OH-;
(5)氢氧化铝和氢氧化钠反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(6)用惰性电极电解饱和氯化钠溶液的化学方程式为2NaCl+2H2O=2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O=2NaOH+H2↑+Cl2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) ![]() Fe(s)+CO2(g) ΔH>0。
Fe(s)+CO2(g) ΔH>0。
已知在1100 ℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值________(填“增大”、“减小”或“不变”);
②1100 ℃时测得高炉中,[CO2]=0.025 mol·L-1,[CO]=0.1 mol·L-1,则在这种情况下,该反应向______进行(填“左”或“右”),判断依据是__________________________。
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
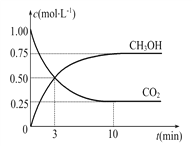
①从反应开始到平衡,氢气的平均反应速率v(H2)=____。
②反应达到平衡后,下列措施能使![]() 增大的是_____(填符号)。
增大的是_____(填符号)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是
A、化学反应必然伴随能量变化
B、需加热才能发生的化学反应一定是吸热反应
C、化学反应中的能量变化主要是由化学键的断裂和形成引起的
D、反应物与生成物总能量的相对大小决定反应是吸热或放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积不变的容器中,加入3molSO2和2molO2 及固体催化剂,使之反应。2SO2(g) + O2 (g) ![]() 2SO3 (g) ;△H=-196.6kJ/mol。平衡时容器内气体压强为起始时的90%。此时。
2SO3 (g) ;△H=-196.6kJ/mol。平衡时容器内气体压强为起始时的90%。此时。
Ⅰ、加入3molSO2和2molO2 发生反应,达到平衡时,放出的热量为 ___________ 。
Ⅱ、保持同一反应温度,在相同的容器中,将起始物质的量改为amolSO2、bmolO2、cmolSO3(g),欲使平衡时SO3的体积分数为2/9 ,
①达到平衡时,Ⅰ与Ⅱ放出的热量________(填序号)。
A、一定相等 B、前者一定小 C、前者大于或等于后者 D.无法判断
②a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示)__________、______。
③欲使起始时反应表现为向正反应方向进行,a的取值范围是:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,离子能大量共存的是
A.Cl-、K+、Cu2+、SO32-B.Cl-、K+、Fe3+、SCN-
C.F-、Na+、Al3+、Cl-D.F-、Na+、Ag+、NO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 氢氧化铜和盐酸反应:OH-+H+=H2O
B. 钠和水反应:Na+2H2O=Na++2OH-+H2↑
C. 铁和稀硝酸反应:Fe+2H+=Fe2++H2↑
D. 常温下,NaOH溶液和Cl2反应:2OH-+Cl2=Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到目的的是( )
A.用排水集气法收集HCl气体
B.用燃烧的木条检验N2和CO2
C.用KSCN溶液检验溶液中的Fe3+
D.用丁达尔效应鉴别Na2CO3溶液和NaHCO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com