
【题目】
碱金属及碳族元素在科研领域、生活和生产方面有广泛的应用。回答下列问题:
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是__________(填元素符号),该元素基态原子最外层电子的自旋状态___________(填“相同”或“相反”)。
(2)碳和硅的有关化学键键能如下所示:
化学键 | C-H | C-O | Si-H | Si-O |
键能/kJmol-1 | 413 | 336 | 318 | 452 |
SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________。
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。
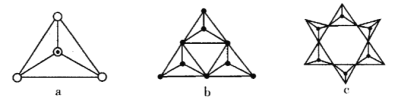
硅氧四面体中Si的轨道杂化类型为____________; 图b环状结构硅酸根的化学式为______________若在环状结构中硅的原子数为n,写出环状结构中硅酸根的通式_____________。
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为___________,其晶格能可通过下图的Borm-Haber循环计算得到。

从上图可知,K原子的第一电离能为_____ kJ/mol, Br-Br键键能为______kJ/ mol,KBr的晶格能为______kJ/mol,晶格能越大,该晶体的熔点越______。
【答案】Mg 相反 C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键 sp3杂化 (SiO3)36- SinO3n2n- 离子晶体 418.8 193.0 689.1 高
【解析】
(1)由对角线规格可知,Li与Mg性质相似,Mg的原子核外M层电子有2个,根据构造原理分析;
(2)键能越小,化学键越不稳定,反应倾向于形成稳定性更强方向进行;
(3)根据Si原子最外层电子数及结合的原子个数分析判断,根据b中含有的正四面体个数确定其化学式,再分析判断c,找出原子个数、电荷数目关系,得到物质是化学式通式;
(4)根据晶体构成微粒判断晶体类型,根据有关概念判断化学键的键能、晶格能大小,利用晶格能与物质熔沸点的关系判断物质熔沸点的高低。
(1)在周期表中,与Li的化学性质最相似的邻族元素是Mg,该元素是12号元素,核外电子排布是1s22s22p63s2,在同一轨道上最多容纳2个自旋方向相反的电子,所以在Mg原子基态原子核外M层电子2个电子的自旋状态相反;
(2)由表中数据可知,C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键,所以SiH4的稳定性小于CH4,更易生成氧化物SiO2;
(3)硅氧四面体中Si原子与4个O原子形成4个σ键,无孤电子对,因此其立体构型为正四面体,Si原子轨道杂化类型为sp3杂化;
b中含有3个四面体结构,所以含有3个Si原子,含有的氧原子数为9,含有氧原子数比3个硅酸根离子少6个3,带有的电荷为:3×(-2)=-6,该离子化学式是(SiO3)36-;
c中含有6个四面体结构,所以含有6个Si原子,含有的氧原子数为18,含有氧原子数比6个硅酸根离子少6个O,带有的电荷为:6×(-2)=-12;根据图示可知:若一个单环状离子中Si原子数为n(n≥3),则含有n个四面体结构,含有的氧原子比n个硅酸根离子恰好少n个O原子,即:含有n个Si,则含有3n个O,带有的负电荷为:n×(-2)=-2n,其化学式为:SinO3n2n-;
(4)KBr晶体由K+、Br-通过离子键结合形成离子晶体;根据示意图可知K原子的第一电离能为418.8kJ/mol;![]() molBr2蒸气转化为Br气态原子吸收能量96.5kJ,则Br-Br键键能96.5kJ/mol×2=193.0kJ/mol;
molBr2蒸气转化为Br气态原子吸收能量96.5kJ,则Br-Br键键能96.5kJ/mol×2=193.0kJ/mol;
晶格能是气态离子形成1mol离子晶体释放的能量,则根据图示,结合盖斯定律可得(89.2+418.8)+(15.5+96.5-324.7)kJ/mol-QkJ/mol=-393.8kJ/mol,解得Q=+689.1kJ/mol;
离子晶体的晶格能越大,离子之间的作用力就越强,断裂消耗的能量就越大,因此该晶体的熔点越高。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车电池反应为FePO4+Li![]() LiFePO4。下列有关LiFePO4电池的说法不正确的是( )
LiFePO4。下列有关LiFePO4电池的说法不正确的是( )
A.该电池充电时,阳极的电极反应式为:LiFePO4-e-=FePO4+Li+
B.该电池可用H2SO4溶液作电解质溶液
C.该电池放电时,电池内部的Li+向正极移动
D.在该电池的放电过程中,电池正极的质量逐渐增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,A-E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。
(1)E元素在周期表中的位置为__________;B、C的氢化物稳定性强的是________(用化学式表示,下同);B、C、D组成的化合物中含有的化学键为_____________
(2)D2C2的电子式是_________,将D的单质投入A2C中,反应后得到一种无色溶液,E的单质在该无色溶液中反应的离子方程式为______________;
(3)元素D的单质在一定条件下,能与A单质化合生成氢化物DA,熔点为800℃。DA能与水反应放出氢气,化学反应方程式为_____________。
(4)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.3-环己二酮(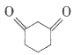 )常用作医药中间体,用于有机合成。下列是一种合成1,3-环己二酮的路线。
)常用作医药中间体,用于有机合成。下列是一种合成1,3-环己二酮的路线。
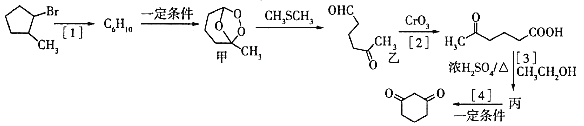
回答下列问题:
(1)写出甲的分子式___,乙中含有官能团的名称是___。
(2)反应的[2]反应类型是___,反应[3]的反应类型是___。
(3)丙的结构简式是___。
(4)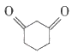 的同分异构体较多,请写出任意一种符合下列条件的同分异构体的结构简式___。
的同分异构体较多,请写出任意一种符合下列条件的同分异构体的结构简式___。
①属于链状化合物
②核磁共振氢谱中有两组吸收峰
③在加热条件下和新制氢氧化铜悬浊液反应生成砖红色沉淀
(5)设计以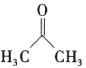 (丙酮)、乙醇、乙酸为原料制备
(丙酮)、乙醇、乙酸为原料制备![]() (2,4-戊二醇)的合成路线(无机试剂任选)___。
(2,4-戊二醇)的合成路线(无机试剂任选)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示。下列有关P4S3的说法中不正确的是( )
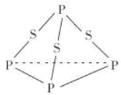
A.P4S3中各原子最外层均满足 8 电子稳定结构
B.P4S3中磷元素为+ 3 价
C.P4S3中 P 原子和 S 原子均为 sp3杂化
D.1molP4S3分子中含有 6mol 极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与Cl原子结合形成的RCl5分子在气态和液态时,分子结构如图所示,下列有关于RCl5分子的说法中不正确的是( )
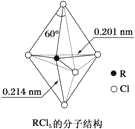
A.分子中5个R-Cl键的键能不都相同
B.键角(Cl-R-Cl)有90°、120°、180°几种
C.每个原子都达到8电子稳定结构
D.RCl5受热分解生成的RCl3分子的立体结构呈三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:

下列说法不正确的是
A. 装置②中试剂可以是NaOH溶液
B. 装置③的作用是干燥O2
C. 收集氧气应选择装置a
D. 装置②、③之间应增加盛澄清石灰水的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化亚铜(CuH)是-种难溶的物质,可用CuSO4溶液和“另一种物质”在40C~50C时反应来制备,CuH不稳定,它既能与HCl反应产生气体,又能在氯气中燃烧,以下有关判断不正确的是 ( )
A. CuH既可做氧化剂又可做还原剂
B. 另一种物质一定具有还原性
C. CuH跟HCl反应的化学方程式为:2CuH+2HCl=CuCl2+2H2↑+Cu
D. CuH在Cl2燃烧的化学方程式为:CuH+Cl2 ![]() CuCl+HCl
CuCl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如下图所示:

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是________;b的名称是________;
(2)a中发生主要反应的化学方程式为____________________________;本实验最容易产生的有机副产物的结构简式为________。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加人无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
(3)用碳酸钠溶液洗涤的作用是________,操作X的名称为________。
Ⅲ.产物分析及产率计算
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有_______种不同化学环境的氢原子。
② 本实验所得环己烯的产率是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com