
【题目】科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJmol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJmol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=___kJmol-1。
(2)利用氧化氮氧化物的流程如下:
![]()
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,
若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_________L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_________(填“增大”、“减小”或“不变”);试计算溶液中c(SO32-)/c(HSO3-)=_______。(常温下H2SO3的电离常数:Ka1=1×10-2 mol/L,Ka2=6.0×10-8mol/L)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol·L-1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入________;为确保溶液中不出现浑浊,应调节溶液的pH不超过______。(常温下,Ksp[Fe(OH)2]=1.8×10-16)
【答案】 -1160 6.72L 增大 60 铁粉 6
【解析】
(l)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJmol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJmol-1,根据盖斯定律:②×2—①,则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=—1160kJmol-1,所以答案为:-1160。
(2)根据题给流程图知,反应Ⅱ为二氧化氮与亚硫酸钠溶液反应生成氮气和硫酸钠,化学方程式为2NO2+4Na2SO3![]() N2+4Na2SO4;由已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,知,生成1molNO2转移5mol电子,若反应I中转移3mol电子,则反应Ⅰ 中生成0.6molNO2,由反应Ⅱ可知,生成N2的物质的量为0.3mol,标准状况下体积为6.72L。
N2+4Na2SO4;由已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,知,生成1molNO2转移5mol电子,若反应I中转移3mol电子,则反应Ⅰ 中生成0.6molNO2,由反应Ⅱ可知,生成N2的物质的量为0.3mol,标准状况下体积为6.72L。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中溶液由强碱溶液转化为水解呈碱性的盐溶液,水的电离平衡向右移动,电离程度增大;由H2SO3的二级电离常数表达式表达式知, ![]() =Ka2/c(H+)=6.0×10—8/10—9=60。正确答案:60.
=Ka2/c(H+)=6.0×10—8/10—9=60。正确答案:60.
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol·L-1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入铁粉。正确答案;铁粉。因Ksp[Fe(OH)2]=1.8×10-16)由C2(OH-) C( Fe2+)= Ksp[Fe(OH)2] 知C(OH-)=1×10-8 mol/L则c(H+)=1×10-6 所以pH=6


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
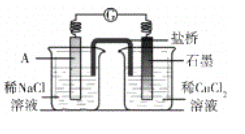
【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
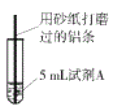
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法不正确的是
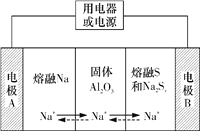
A. 放电时,电极A为负极,Na+由A极向B极移动
B. 该电池不能在常温下工作
C. 充电时,电极B连接外电源的负极
D. 放电时,B极的电极反应式为xS+2e-===S![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠及其化合物的说法正确的是( )
A.将剩余的金属钠丢弃在废纸篓里
B.小苏打可用于制作糕点的膨松剂,苏打可用于治疗胃酸过多
C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
D.生活中用热的烧碱溶液洗去油污
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com