
| A. | 稀硫酸 | B. | 水 | C. | 溴水 | D. | 酸性高锰酸钾 |
分析 CCl4、苯不溶于水,但二者密度不同,CCl4密度比水大,苯的密度比水小,甲苯可使KMnO4酸性溶液褪色.
解答 解:A.CCl4、苯、甲苯都不溶于硫酸,且不反应,不能鉴别苯和甲苯,二者密度都比水小,故A错误;
B.CCl4、苯、甲苯都不溶于水,不能鉴别苯和甲苯,故B错误;
C.CCl4、苯、甲苯与溴水都不反应,不能鉴别苯和甲苯,二者密度都比水小,故C错误;
D.甲苯可使KMnO4酸性溶液褪色,虽然苯、四氯化碳都不反应,但二者密度不同,CCl4密度比水大,苯的密度比水小,可鉴别,故D正确;
故选D.
点评 本题考查有机物鉴别,为高频考点,明确物质性质、密度、溶解性是解本题关键,利用物质差异性分析解答,注意:连接苯环的碳原子上含有氢原子的苯的同系物能被酸性高锰酸钾溶液氧化,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:推断题
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;液溴的保存通常采取的方法是水封在棕色瓶中,密闭保存.
;液溴的保存通常采取的方法是水封在棕色瓶中,密闭保存.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜属于重金属,但其盐有毒,所以铜质器皿不安全,应该禁用 | |
| B. | 燃煤中加入生石灰可以减少二氧化硫的排放 | |
| C. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| D. | 钠在空气和氯气中燃烧,火焰颜色和生成固体颜色都不 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
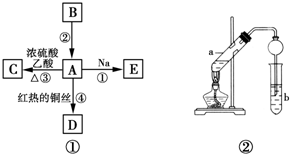
 用图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )
用图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )| 选项 | 气体 | a | b | c | d |
| A | SO2 | 浓硫酸 | Cu | H2O | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl溶液 | 消石灰 | 空集气瓶 | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基、甲基电子数相同 | |
| B. | 所有烃基和苯基都不是官能团 | |
| C. | 甲醛和一氯甲烷在常温下呈气态,而溴乙烷、苯甲酸、饱和高级脂肪酸甘油酯在常温 下呈液态 | |
| D. | 不含羟基和羧基的有机物水溶性都较差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2能与大多数金属反应 | |
| B. | N2是大气中的主要成分之一,雷雨时可直接转化为NO2 | |
| C. | 硫是一种黄色的能溶于水的晶体,既有氧化性又有还原性 | |
| D. | 硅是应用广泛的半导体材料,常温下化学性质活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氨气是一种重要的化工产品,在生产和科研中应用广泛,氨气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:
氨气是一种重要的化工产品,在生产和科研中应用广泛,氨气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:| 弱电解质 | 化学式 | 电离常数(K) |
| 氨水 | NH3•H2O | 1.79×10-5 |
| 碳酸 | H2CO3 | K1=4.30×10-7 |
| K2=5.61×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com