
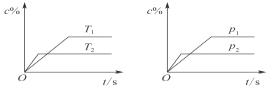
【题目】对于可逆反应mA(s)+nB(g)![]() eC(g)+fD(g),当反应过程中其他条件不变时,C的质量分数(c%)与温度(T)和压强(p)的关系如图所示。下列叙述正确的是( )
eC(g)+fD(g),当反应过程中其他条件不变时,C的质量分数(c%)与温度(T)和压强(p)的关系如图所示。下列叙述正确的是( )
A. 达到平衡后,若使用催化剂,C的质量分数将增大
B. 达到平衡后,增加A的量有利于化学平衡向正方向移动
C. 化学方程式中n>e+f
D. 达到平衡后,若升高温度,化学平衡向逆方向移动
【答案】D
【解析】
由左图可知,根据先拐先平衡,条件高,则温度升高C的百分含量降低,说明升高温度平衡向逆反应方向移动,则该反应的正反应为放热反应,同理由右图可以看出增大压强,C的百分含量降低,说明增大压强平衡向逆反应方向移动,则应有n<e+f。
由左图可知,根据先拐先平衡,条件高,则温度升高C的百分含量降低,说明升高温度平衡向逆反应方向移动,则该反应的正反应为放热反应,同理由右图可以看出增大压强,C的百分含量降低,说明增大压强平衡向逆反应方向移动,则应有n<e+f;
A.达到平衡后,加入催化剂不会影响化学平衡的移动,C的百分含量不变,故A错误;
B.达到平衡后,A是固体,不影响平衡移动,所以增加A的量平衡不移动,故B错误;
C.压强增大,C%含量降低,说明平衡逆向进行,正反应是气体体积增大的反应,n<e+f,故C错误;
D.该反应的正反应是放热反应,达到平衡后,若升温,平衡向逆方向移动,故D正确;
故答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是
①SO2 ②CH3CH2CH=CH2 ③![]() ④ CH3CH3
④ CH3CH3
A. ①②③④B. ③④
C. ①②④D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是

A. Z、N两种元素的离子半径相比,前者大
B. X、N两种元素的氢化物的沸点相比,前者较低
C. M比X的原子序数多7
D. Z单质均能溶解于Y的氢氧化物和N的氢化物的水溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,下列关于其有利因素的说法中,你认为不妥的是
A. 便于运输、储存,从安全角度考虑,硅是最佳的燃料
B. 自然界的含硅化合物易开采
C. 硅燃烧放出的热量大,燃烧产物对环境污染程度低且容易有效控制
D. 自然界中存在大量单质硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)![]() 2HF(g)+270kJ,下列说法正确的是( )
2HF(g)+270kJ,下列说法正确的是( )
A. 2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B. 1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C. 在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D. 1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(B)=0.3mol/(L· s) B. v(A)=0.5mol/(L· min)
C. v(C)=0.8mol/(L· s) D. v(D)=1mol/(L· min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
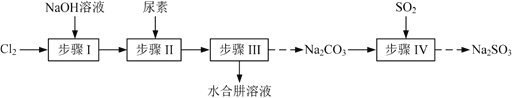
已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题图2所示,Na2SO3的溶解度曲线如题图3所示)。
随pH的分布如题图2所示,Na2SO3的溶解度曲线如题图3所示)。
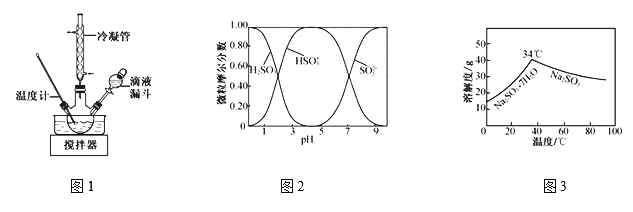
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装(结合图2、图3说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和氨水中存在化学平衡和电离平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() +OH-。下列有关说法正确的是( )
+OH-。下列有关说法正确的是( )
A. 常温下饱和氨水的pH<7
B. 向氨水中滴加过量硫酸,所有平衡均正向移动,pH增大
C. 电离是吸热过程,升高温度,所有平衡均正向移动
D. 向饱和氨水中加入适量NaOH固体,所有平衡均逆向移动,有NH3放出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com