
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是

A.由题给图示可求出25℃时醋酸的电离平衡常 数Ka=10-4.75
B.W点所表示的溶液中:c(Na+)+c(H+) =c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示的1.0L溶液中通入0.05mol HCl气体(溶液体积变化可忽略):c(H+) = c(CH3COOH) + c(OH-)
【答案】D
【解析】
试题分析:A.W点c(CH3COOH)=c(CH3COO-),平衡常数K = ![]() = 10-4.75molL-1,A正确;B.溶液存在电荷守恒,应为c(Na + ) + c(H + ) = c(CH3COO-) + c(OH-),W点时c(CH3COOH)=c(CH3COO-),故c(Na+)+c(H+) = c(CH3COOH)+c(OH-),B正确;C.由电荷守恒及c(CH3COOH) + c(CH3COO-) = 0.1molL-1可知,c(Na + ) + c(H + )-c(OH-) + c(CH3COOH) = c(CH3COO-) + c(CH3COOH) = 0.1mol/L,C正确;D.向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡,溶液中电荷守恒关系为:c(Na + ) + c(H + ) = c(CH3COO-) + c(OH-) + c(Cl-);物料守恒关系为:2c(Cl-) = c(CH3COO-) + c(CH3COOH) = 0.1mol/L,得2c(Na + ) + 2c(H + ) = 3c(CH3COO-) + 2c(OH-) + c(CH3COOH),c(Na + ) = 0.05mol/L,c(CH3COOH) + c(CH3COO-) = 0.1mol/L,所以得c(H + )═c(CH3COO-) + c(OH-),D错误;答案选D。
= 10-4.75molL-1,A正确;B.溶液存在电荷守恒,应为c(Na + ) + c(H + ) = c(CH3COO-) + c(OH-),W点时c(CH3COOH)=c(CH3COO-),故c(Na+)+c(H+) = c(CH3COOH)+c(OH-),B正确;C.由电荷守恒及c(CH3COOH) + c(CH3COO-) = 0.1molL-1可知,c(Na + ) + c(H + )-c(OH-) + c(CH3COOH) = c(CH3COO-) + c(CH3COOH) = 0.1mol/L,C正确;D.向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡,溶液中电荷守恒关系为:c(Na + ) + c(H + ) = c(CH3COO-) + c(OH-) + c(Cl-);物料守恒关系为:2c(Cl-) = c(CH3COO-) + c(CH3COOH) = 0.1mol/L,得2c(Na + ) + 2c(H + ) = 3c(CH3COO-) + 2c(OH-) + c(CH3COOH),c(Na + ) = 0.05mol/L,c(CH3COOH) + c(CH3COO-) = 0.1mol/L,所以得c(H + )═c(CH3COO-) + c(OH-),D错误;答案选D。


科目:高中化学 来源: 题型:
【题目】龙胆酸甲酯是制取抗心律失常药物——氟卡尼的中间体。
I.已知龙胆酸甲酯结构如图所示:
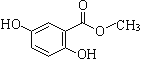
(1)龙胆酸甲酯的官能团名称为 。
(2)下列有关龙胆酸甲酯的描述,不正确的是 (填字母)。
A.难溶于水
B.不能发生消去反应
C.能与溴水反应
D.遇FeCl3溶液能显红色
E.能与碳酸氢钠溶液反应产生二氧化碳
(3)1摩尔龙胆酸甲酯与足量的NaOH溶液反应,最多消耗NaOH mol 。
II.已知X及其他几种有机物存在如下转化关系,且测得A中含三个甲基:
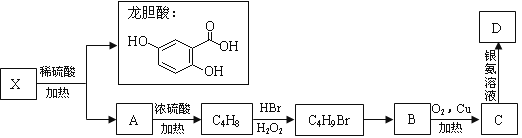
说明:不对称烯烃与卤化氢发生加成反应主要产物遵循以下规则马氏规则:通常情况下,氢加到含氢多的不饱和碳原子一侧反马氏规则:在过氧化物作用下,卤原子加到含氢多的不饱和碳原子一侧
回答以下问题:
(4)X的结构简式为 。
(5)B的系统命名是___________________________ 。
(6)写出C生成D的化学方程式 (用结构简式表示)。
(7)写出满足下列条件的龙胆酸的一种同分异构体的结构简式 。
①能发生银镜反应
②能使FeCl3溶液显色
③酯类
④苯环上的一氯代物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四组数字中,代表有机物的4种同系物的式量的( )
A.16.32.48.64
B.16.17.18.19
C.16.30.44.58
D.16.28.40.52
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是 。
(2)调节pH,实验记录如下:
实验 | pH | 现象 |
A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据实验现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:
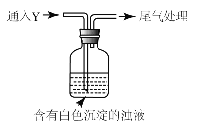
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有含CaO杂质的CaC2试样。设计以下实验,测定CaC2试样的纯度。(反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑),请从下图中选用适当的装置,完成该实验。
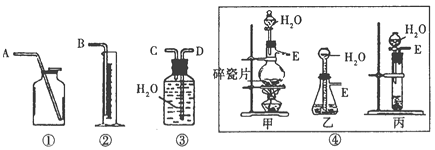
(1)制取C2H2最好选④中的_________装置(填“甲”“乙”或“丙”),所选用装置的连接顺序是_________________。(填各接口A~E的顺序)
(2)若实验时称取的试样为1.4 g,产生的乙炔在标准状况下的体积为448 mL,此试样中CaC2的质量分数为____________。(保留3位有效数字)
Ⅱ.某同学在实验室从如图标签的试剂瓶中取少许钠进行燃烧实验,实验后发现还有少许黑色固体生成。从反应物及实验操作猜测:

该黑色物质可能为炭与另一种氧化物组成的混合物。根据题意和图示回答下面问题:
(1)装置图⑤中A的名称_______________。
(2)此氧化物可能是___________或___________(写化学式)。
(3)对黑色固体物质的组成作如图⑥所示探究

①实验I加入盐酸溶液的目的是________________。
②仅通过实验Ⅱ,用最简步骤能快速确定黑色氧化物的组成,请完善该设计。(限选试剂:稀盐酸、KSCN溶液、10%H2O2溶液)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
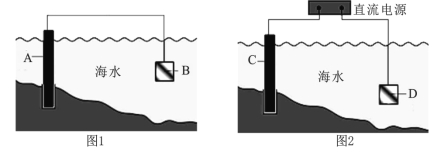
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择 (填字母序号)。
a.碳棒 b.锌板 c.铜板
该电化学保护方法的名称是 。
(2)图2中,钢闸门C为 极,用氯化钠溶液模拟海水进行实验,D为石墨块,总反应的离子方程式为 。
(3)有关上述实验,下列说法正确的是 。
A.溶液中Na+向D极移动
B.从D极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(4)模拟工业上离子交换膜法制烧碱的方法,可用如图装置电解硫酸钾溶液来制取H2、O2、H2SO4和KOH。
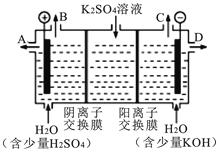
①该电解槽的阳极反应方程式为 。 此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”) 导出。
③若采用CH4燃料电池(石墨为电极,KOH为电解质溶液)为电源,则该电池的负极电极方程式为 ,若B极产生标准状况下22.4 L气体,则理论上需要通入 mol CH4。
④电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。
(1)还原沉淀法是处理含Cr2O72-和CrO42-工业废水的一种常用方法,其工艺流程为:
![]()
其中第Ⅰ步存在平衡:2Cr2O42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①若平衡体系的pH=0,该溶液显__________色。
②根据 2Cr2O42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为_________,图中右侧电极连接电源的_________极,其电极反应式为_________________。
Cr2O72-(橙色)+H2O设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为_________,图中右侧电极连接电源的_________极,其电极反应式为_________________。
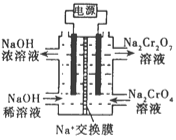
③第Ⅱ步反应的离子方程式:_________________________。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。完成该反应的化学方程式:
![]()
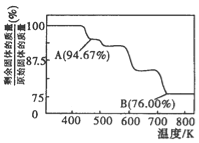
(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数。下列说法正确的是
A.标准状况下,7.8g苯中含有的碳碳双键数是0.3NA
B.标准状况下,11.2L四氯甲烷所含分子数为0.5NA
C.常温常压下,14g乙烯分子中含有的碳碳键数目为2NA
D.1mol甲基(-CH3)所含电子数为9NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com