
����Ŀ���Ե���Ϊ��Ҫԭ�Ϻϳ�һ�־��й���ζ������C�ͻ�����D�ĺϳ�·����ͼ��ʾ��
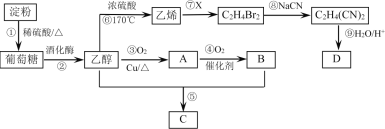
�ش��������⣺
(1)���۵���ɿɱ�ʾΪ___________��A�����еĹ���������Ϊ__________��
(2)��Ӧ��������X�ķ���ʽΪ________����Ӧ�������Ϊ______________��
(3)��Ӧ�ݵĻ�ѧ����ʽΪ________________________________________________��
(4)��Ӧ������ʵ��������ϩ��Ϊ��ȥ���п��ܻ��е�SO2����ѡ�õ��Լ���________��
A����ˮ B������KMnO4��Һ C. NaOH��Һ D��Ũ����
(5)��֪D����Է�����Ϊ118������̼������Ԫ�ص����������ֱ�Ϊ40.68%��5.08%������Ϊ��Ԫ�أ���D�ķ���ʽΪ____________��
(6)Ϊ��֤����Ӧ���Ƿ�������ȡ�ٷ�Ӧ�����Һ2mL��һ֧�Թ��У���____������Һ�����ԣ��������м���2 mL_____���ټ���4��5��_____���������������ṩ�Լ�����ĸ��գ�������һ��ʱ�䣬����______________�����������֤����Ӧ���ѷ�����
ʵ���пɹ�ѡ����Լ���
A��10%��NaOH��Һ B��2%�İ�ˮ C��5%��CuSO4��Һ D����ˮ
���𰸡� (C6H10O5)n ȩ�� Br2 ȡ����Ӧ CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O C C4H6O4 A A C ש��ɫ����
CH3COOCH2CH3+H2O C C4H6O4 A A C ש��ɫ����
��������
�����ڴ�������������ˮ�����������ǣ��������ھƻ�ø�������·ֽ������Ҵ��Ͷ�����̼���Ҵ���Cu���������·�������������AΪCH3CHO��CH3CHO��һ����������BΪCH3COOH��CH3COOH��CH3CH2OH����������Ӧ����CΪCH3COOC2H5���Ҵ�������ȥ��Ӧ������ϩ����ϩ��Br2�����ӳɷ�Ӧ����BrCH2CH2Br��BrCH2CH2Br��NaCN����ȡ����Ӧ����NC-CH2CH2-CN���Դ˽��
��1�����۵���ɿɱ�ʾΪ(C6H10O5)n��A����ȩ�������еĹ���������Ϊȩ����
��2������ԭ���غ��֪��Ӧ��������X�ķ���ʽΪBr2���������Ϸ�����֪��Ӧ�������Ϊȡ����Ӧ��
��3����Ӧ����������Ӧ����Ӧ�Ļ�ѧ����ʽΪCH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O��
CH3COOCH2CH3+H2O��
��4��A����ˮ��������������Ҳ����ϩ�����ӳɷ�Ӧ��A����
B������KMnO4��Һ��������������Ҳ��������ϩ��B����
C. NaOH��Һ�����������Ӧ������ϩ����Ӧ��C��ȷ��
D��Ũ��������ն�������D����
��ѡC��
��5��D����Է�����Ϊ118������̼������Ԫ�ص����������ֱ�Ϊ40.68%��5.08%������Ϊ��Ԫ�أ��������N��C����118��40.68%/12��4��N��H����118��5.08%/1��6��N��O����(11812��46)/16��4����D�ķ���ʽΪC4H6O4��
��6�����鷴Ӧ���Ƿ�����ֻ��Ҫ���������������ɼ��ɡ�����������������������ͭ����Һ�ķ�Ӧ��Ҫ�ڼ�����Һ�У�������ˮ����������Һ�У���Ϊ��֤����Ӧ���Ƿ�������ȡ�ٷ�Ӧ�����Һ2mL��һ֧�Թ��У���10%��NaOH��Һ������Һ�����ԣ��������м���2 mL10%��NaOH��Һ���ټ���4��5��5%��CuSO4��Һ������һ��ʱ�䣬����ש��ɫ���������������֤����Ӧ���ѷ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���д���пհף�
�������� | I A | IIA | IIIA | IVA | VA | VIA | VIIA | 0�� |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | �� |
(1)����ЩԪ���У���ѧ��������õ�Ԫ�ص�ԭ�ӽṹʾ��ͼΪ_______��Ԫ�آ������ڱ��е�λ��Ϊ________________��
(2)������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ��_________��������ǿ�Ļ�����ĵ���ʽ��_______���ݵĵ����ڸû������ˮ��Һ�з�Ӧ�����ӷ���ʽΪ_____��
(3)�õ���ʽ��ʾԪ�آ���Ļ�������γɹ���___________________���û���������_____(����ۡ������ӡ�)�����
(4)�ۡ��ޡ�������Ԫ���γɵ����ӣ����Ӱ뾶�ɴ�С��˳����_____(�û�ѧʽ��ʾ)��
(5)Ԫ�آٵ�����⻯��ĽṹʽΪ________����û��������һ��CH2��ͬϵ��������γ�ȼ�ϵ�أ�д���������Һ�ʼ���ʱ�����ĵ缫��Ӧʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ȡ﮺�﮵Ļ������ԭ�ϣ��õ�ⷨ�Ʊ�������﮵Ĺ���ԭ������ͼ��ʾ,������������ȷ����
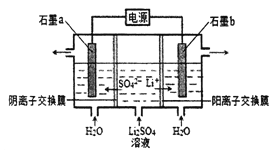
A. b��������Һ��pH����
B. a����ӦΪ2H2O-4e-= O2��+4H+
C. �÷��Ʊ�LiOH���ɵõ������H2
D. ����·��ͨ��1mol ����ʱ����2mol LiOH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ����ÿ����������ʧ�ĸ�����Լռ�����������ʮ��֮һ��һ�ָ�����ʴԭ��ʾ��ͼ���ң�����˵������ȷ����

A. ȱ������Fe��2e��=== Fe2+
B. ��������O2 + 2H2O + 4e��=== 4OH��
C. Feʧȥ�ĵ���ͨ���������Һ���ݸ�O2
D. ����������������Һ������Ч��ֹ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ�����ӷ���ʽ����ȷ����
A. ��Ƭ����NaOH��Һ�������������2Al + 2OH��+ 2H2O===2AlO2��+3H2��
B. ��K2Cr2O7��Һ�еμ�����ŨH2SO4����Һ��ɫ��� Cr2O72��(��ɫ) + H2O![]() 2CrO42��(��ɫ) + 2H+
2CrO42��(��ɫ) + 2H+
C. ��Na2SiO3��Һ��ͨ�����CO2�Ʊ�����������SiO32��+ CO2 + H2O===H2SiO3�����壩+ CO32��
D. ��Na2CO3��Һ���ݹ�¯ˮ������CaSO4����CaSO4 + CO32��![]() CaCO3 + SO42��
CaCO3 + SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ķ�����ʵ�����ݣ�������ĿҪ��ش����⣺
ijѧ��Ϊ�ⶨδ֪Ũ�ȵ�������Һ��ʵ�����£���1.00mL������������100mLϡH2SO4��Һ����0.14 mol��L��1��NaOH��Һ�ζ�����ϡH2SO4 25.00mL���ζ���ֹʱ����NaOH��Һ15.00mL��
��1����ʽ�ζ���������ˮ��ϴ��δ�ñ�Һ��ϴ���µζ����_____________������ƫС������ƫ����������Ӱ��������
��2������ϡH2SO4��Һ������ʹ�õ���Ҫ������_________________��
��3���������������Һ�����ʵ���Ũ�ȣ�������������С�����ڶ�λ��___________��
��4��������0.175mol/L��������Һ500mL���ɲ����������ַ�����
����һ����������ƽ��ȡ_______g��ˮ�����ƣ���������ˮ�У����500mL��Һ��
���������������Ϊ250 mL��Ũ�Ⱦ�Ϊ________�Ĵ�����������������Һ��϶��ɣ����Ϻ��������ڻ��ǰ�������֮�ͣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л���Ľṹ�����ʵ��й���������ȷ����
A. �������Ҵ����Է���������Ӧ���־���������Ʒ����û���Ӧ
B. ��ϩ������ϩ������ϩ����ʹ���Ը��������Һ��ɫ
C. �������������仯���ѻ����ѽⶼ�ǻ�ѧ�仯
D. ��ά�ء�����ϩ�����ά�����ڸ߷��ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ȡ��һ�ַ��㻯��������ʽΪC8H8O3����FeCl3��Һ�����������ɫ���ܷ���������Ӧ���û�������ܵĽṹ��ʽ�ǣ� ��
A.  B.
B.  C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���������м�ˮϡ�ͣ���Һ���������仯�����ͼ��ʾ���ش��������⡣
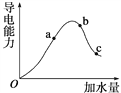
��1����O����ʱҺ�岻�ܵ��磬˵��������________���Ӽ�(��������������������)��
��2��a��b��c����������̶��ɴ�С��˳��Ϊ________��a��b��c�����Ӧ����Һ��c(H��)������________��
��3��Ҫʹc����Һ��c(CH3COO��)�����c(H��)��С���ɲ�ȡ�����ִ�ʩ��______________��
��4����ʵ����c�㴦��Һ��c(CH3COOH)��0.1 mol��L��1��c(CH3COO��)��0.001 mol��L��1�����������CH3COOH�ĵ��볣��Ka��________��
��5����ϡ�����У����Ŵ���Ũ�ȵĽ��ͣ�����ʼ�ձ����������Ƶ�����________________
A��c(H��) B��H������
C��CH3COOH������ D.![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com