
【题目】全世界每年因生锈损失的钢铁,约占世界年产量的十分之一。一种钢铁锈蚀原理示意图如右,下列说法不正确的是

A. 缺氧区:Fe-2e-=== Fe2+
B. 富氧区:O2 + 2H2O + 4e-=== 4OH-
C. Fe失去的电子通过电解质溶液传递给O2
D. 隔绝氧气或电解质溶液均可有效防止铁生锈
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】储氢材料是科学研究的热点之一。
(1)无机盐储氢原理:NaHCO3(s)+H2(g) ![]() HCOONa+H2O,HCOONa中的化学键类型有____;在NaHCO3中,C、H、O的电负性由大到小的顺序为_________。
HCOONa+H2O,HCOONa中的化学键类型有____;在NaHCO3中,C、H、O的电负性由大到小的顺序为_________。
(2)近年来,研究人员发现苯和甲苯都是比较理想的有机液体储氢材料。C6H6(苯)+3H2![]() C6H12(环已烷);C6H5-CH3(甲苯)+3H2
C6H12(环已烷);C6H5-CH3(甲苯)+3H2![]() C6H11-CH3(甲基环己烷)
C6H11-CH3(甲基环己烷)
①甲苯分子中碳原子的杂化类型是__________;
②能体现环已烷分子的空间构型的键线式为____________。
(3)金属钛具有较强的储氢能力。钛的储氢反应为Ti+H2![]() TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
①CO能形成Ni(CO)4,沸点为42.2℃,Ni(CO)4的晶体类型为______________,CO与N2互为等电子体,标准状况下,VL CO分子形成Ni(CO)4中含o键数目为________。
②基态钛原子中电子能量最高的电子排布图为_________
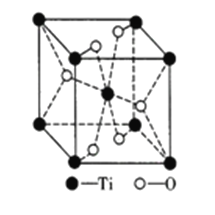
③钛的氧化物晶胞如图所示。该钛的氧化物晶体的化学式为_______已知钛的氧化物晶胞参数为a·10-3μm,NA代表阿伏加德罗常数的值,则该晶体的密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰铵晶体可用作织物和木材加工的防火剂等。由二氧化锰等作原料制取硫酸锰铵晶体步骤如下:
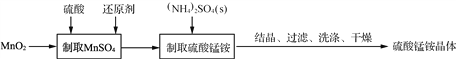
(1)实验前,需称量MnO2的质量,这是因为____________________________。
(2) “制取MnSO4”时,可用C6H12O6(葡萄糖)、H2C2O4(草酸)等物质作还原剂。
①用C6H12O6作还原剂(被氧化为CO2)时,发生反应的n(MnO2)/n(C6H12O6)=________。
②用H2C2O4作还原剂,发生反应的化学方程式为____________________________。
(3)一种测定硫酸锰铵晶体[设为: (NH4)xMny(SO4)z·wH2O]组成的方法如下:
①称取一定量的硫酸锰铵晶体配成250 mL溶液A。
②取25.00 mL溶液A加入足量的BaCl2溶液得BaSO4 0.512 6 g。
③另取25.00 mL溶液A加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min[4NH![]() +6HCHO===3H++6H2O+(CH2)6N4H+,滴定时,1 mol(CH2)6N4H+与1 mol H+相当],加入1~2滴酚酞溶液,用0.100 0 mol·L-1 NaOH标准溶液滴定至终点(在该过程中Mn2+不沉淀),消耗NaOH溶液22.00 mL。
+6HCHO===3H++6H2O+(CH2)6N4H+,滴定时,1 mol(CH2)6N4H+与1 mol H+相当],加入1~2滴酚酞溶液,用0.100 0 mol·L-1 NaOH标准溶液滴定至终点(在该过程中Mn2+不沉淀),消耗NaOH溶液22.00 mL。
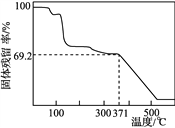
④取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在371 ℃时已完全失去结晶水)。根据以上实验数据计算确定硫酸锰铵晶体的化学式(写出计算过程)。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过反应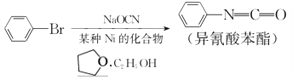 ,可制备有机中间体异氰酸苯酯。
,可制备有机中间体异氰酸苯酯。
(1) Ni3+基态核外电子排布式为________。
(2)异氰酸苯酯分子中碳原子杂化轨道类型是________,1 mol异氰酸苯酯分子中含有σ键数目为________。
(3)Na、O、C、N四种元素的第一电离能从大到小的顺序为_________________________。
(4) C2H5OH的沸点高于![]() ,这是因为__________________。
,这是因为__________________。
(5) Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如右图所示,该合金的化学式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) =2NO(g)+O2(g) (正反应吸热)。实验测得:v正= v(NO2)消耗= k正c2(NO2) v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法不正确的是
容器 编号 | 物质的平衡浓度(mol/L) | 物质的起始浓度(mol/L) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 温度为T1,反应达平衡时,容器Ⅲ中的平衡常数K=0.8
B. 达平衡时,速率常数和化学平衡常数的关系K= k正/k逆
C. 当温度改变为T2时,若k正=k逆则T21
D. 容器Ⅱ反应达平衡前,v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如图所示。
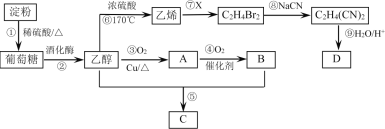
回答下列问题:
(1)淀粉的组成可表示为___________,A分子中的官能团名称为__________。
(2)反应⑦中物质X的分子式为________,反应⑧的类型为______________。
(3)反应⑤的化学方程式为________________________________________________。
(4)反应⑥可用于实验室制乙烯,为除去其中可能混有的SO2,可选用的试剂是________。
A.溴水 B.酸性KMnO4溶液 C. NaOH溶液 D.浓硫酸
(5)已知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的分子式为____________。
(6)为了证明反应①是否发生,可取①反应后的溶液2mL于一支试管中,用____调节溶液至中性,再向其中加入2 mL_____,再加入4~5滴_____(以上用如下所提供试剂的字母填空),加热一段时间,若有______________现象产生,则证明反应①已发生。
实验中可供选择的试剂:
A.10%的NaOH溶液 B.2%的氨水 C.5%的CuSO4溶液 D.碘水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作过程中实验现象的变化只有一次的是( )
A.石蕊试液中逐滴滴加氯水
B.酚酞试液中加入过氧化钠固体
C.氢氧化铁胶体中逐滴滴加硫酸
D.碳酸钠溶液中逐滴滴加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A. V(NaOH)=0时,c(H+)=1×10-2mol/L
B. V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C. V(NaOH)=10mL时,c(H+)=1×10-7mol/L
D. V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com