
【题目】通过反应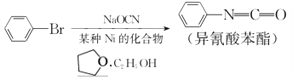 ,可制备有机中间体异氰酸苯酯。
,可制备有机中间体异氰酸苯酯。
(1) Ni3+基态核外电子排布式为________。
(2)异氰酸苯酯分子中碳原子杂化轨道类型是________,1 mol异氰酸苯酯分子中含有σ键数目为________。
(3)Na、O、C、N四种元素的第一电离能从大到小的顺序为_________________________。
(4) C2H5OH的沸点高于![]() ,这是因为__________________。
,这是因为__________________。
(5) Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如右图所示,该合金的化学式为________。

【答案】 [Ar]3d7或1s22s22p63s23p63d7 sp和sp2 14 mol N>O>C>Na 乙醇分子间存在氢键 Ni3Al
【解析】(1) Ni3+基态核外电子排布式为1s22s22p63s23p63d7或[Ar]3d7
(2)异氰酸苯酯分子中,苯环上碳原子是sp2杂化,而—N=C=O中的碳原子是sp杂化;1mol 异氰酸苯酯分子中,苯环上含有11个σ键,而—N=C=O中含有3个σ键,所以共计14molσ键,即14NA;
(3)在元素周期表中,第一电离能的一般规律是同周期从左向右逐渐增大,同主族从上到下逐渐减小,所以Na、O、C、N四种元素的第一电离能从大到小的顺序为N >O> C> Na;
(4) C2H5OH 在分子间可形成氢键,而![]() 不能形成分子间氢键,所以C2H5OH 的沸点高于
不能形成分子间氢键,所以C2H5OH 的沸点高于![]() ;
;
(5)根据原子均滩法,该晶胞中Al原子数=![]() =1,Ni原子数=
=1,Ni原子数= ![]() =3,所以该合金的化学式为Ni3Al。
=3,所以该合金的化学式为Ni3Al。


科目:高中化学 来源: 题型:
【题目】下列各溶液中,微粒的物质的量浓度关系正确的是
A. 0.1 mol·L-1 pH<7的NaHSO3溶液中:c(HSO)>c(H2SO3)>c(SO![]() )
)
B. 10 mL 0.5 mol·L-1 CH3COONa溶液与10 mL 1 mol·L-1盐酸混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-)
C. 在NaHCO3溶液中一定有:c(Na+)+c(H+)=c(HCO)+c(OH-)+c(CO![]() )
)
D. c(NH)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄檀内酯是一种具有抗肿瘤、抗菌、抗氧化等生物活性的天然化合物,可由香兰素为原料合成(如下图所示)。
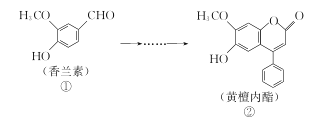
下列说法正确的是( )
A. ①、②分子中碳原子一定都处于同一平面
B. ①、②均能使酸性KMnO4溶液褪色
C. 化合物①能与NaHCO3反应产生CO2
D. 1 mol化合物②最多只能与2molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫氰酸盐、苯酚及硫代硫酸盐是HPF脱硫废液中的主要污染物(其中还含有Cl-、SO![]() 、Na+等),可用NaClO3、H2SO4作脱除的试剂。
、Na+等),可用NaClO3、H2SO4作脱除的试剂。
(1)Cl2与热的NaOH溶液反应生成NaClO3,该反应的化学方程式为____________________________。
(2) 常温时,反应C6H5O-+H2O ![]() C6H5OH+OH-的平衡常数为K=________(C6H5OH的Ka=1×10-10)。
C6H5OH+OH-的平衡常数为K=________(C6H5OH的Ka=1×10-10)。
(3)处理该废水需经预处理和再处理阶段。
①用浓硫酸对600 mL HPF脱硫废液进行酸化预处理(反应温度100℃),其结果如表1所示:
表1 预处理前后三种离子浓度变化情况
项目 | S2O | SCN-(g·L-1) | 苯酚(g·L-1) | pH |
处理前 | 34.28 | 70.11 | 1.3 | 8.55 |
处理后 | 0.91 | 69.76 | 1.35 | 2.4 |
由表1可知,该处理过程中主要被除去的污染物是________。
②对预处理后废液进行再处理(反应温度100 ℃)时,13次依次向废液中加入试剂情况如表2所示:
表2 13次依次加入试剂情况
次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
NaClO3/g | 16.3 | 0 | 0 | 0 | 0 | 0 | 7.6 | 0 | 5.7 | 0 | 10.9 | 0 | 7.1 |
浓H2SO4/mL | 0 | 2 | 2 | 2 | 4 | 4 | 0 | 4 | 0 | 4 | 0 | 4 | 0 |
实验结果如图1所示:

前6次苯酚脱除率可达到80%左右,该过程中苯酚转化为白色沉淀(含苯环),这与溶液中ClO![]() 和Cl-反应产生Cl2有关。该白色沉淀可能的结构简式为______________。
和Cl-反应产生Cl2有关。该白色沉淀可能的结构简式为______________。
③由表2和图1中数据得出,第7~13次操作中SCN-在较强酸性条件下被ClO![]() (不水解)氧化的依据是________。此过程中产生大量砖红色沉淀(夹杂少量白色沉淀),对沉淀进行XPS分析,部分元素的物质的量分数如图2所示。已知SCN-可被某些氧化剂(如Cu2+等)最终氧化为砖红色的沉淀(SCN)x。一种推测认为该实验中产生的砖红色沉淀为(SCN)x,支持该推测的证据有:________。
(不水解)氧化的依据是________。此过程中产生大量砖红色沉淀(夹杂少量白色沉淀),对沉淀进行XPS分析,部分元素的物质的量分数如图2所示。已知SCN-可被某些氧化剂(如Cu2+等)最终氧化为砖红色的沉淀(SCN)x。一种推测认为该实验中产生的砖红色沉淀为(SCN)x,支持该推测的证据有:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如下图所示,下列叙述不正确的是
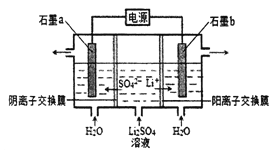
A. b极附近溶液的pH增大
B. a极反应为2H2O-4e-= O2↑+4H+
C. 该法制备LiOH还可得到硫酸和H2
D. 当电路中通过1mol 电子时,有2mol LiOH生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是

A. 外电路的电流方向为X![]() 外电路
外电路![]() Y
Y
B. 若两电极分别为Fe和碳棒,则X 为碳棒,Y 为Fe
C. X 极上发生的是还原反应,Y 极上发生的是氧化反应
D. 若两电极都是金属,则它们的活泼性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因生锈损失的钢铁,约占世界年产量的十分之一。一种钢铁锈蚀原理示意图如右,下列说法不正确的是

A. 缺氧区:Fe-2e-=== Fe2+
B. 富氧区:O2 + 2H2O + 4e-=== 4OH-
C. Fe失去的电子通过电解质溶液传递给O2
D. 隔绝氧气或电解质溶液均可有效防止铁生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下列实验内容,根据题目要求回答问题:
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果_____________(填“偏小”、“偏大”或“无影响”)。
(2)配制稀H2SO4溶液,必须使用的主要容器是_________________。
(3)计算待测硫酸溶液的物质的量浓度(计算结果保留到小数点后第二位)___________。
(4)欲配制0.175mol/L醋酸钠溶液500mL,可采用以下两种方案:
方案一:用托盘天平称取_______g无水醋酸钠,溶于适量水中,配成500mL溶液。
方案二:用体积均为250 mL且浓度均为________的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强碱性溶液中,下列离子组能大量共存的是( )
A.Na+、K+、SO42﹣、Cl﹣
B.Na+、Cu2+、SO42﹣、NO3﹣
C.Mg2+、Na+、SO42﹣、Cl﹣
D.Ba2+、HCO3﹣、NO3﹣、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com