
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮
化钠的工艺流程:

已知 NaN3 能与 AgNO3 反应生成白色难溶于水的 AgN3;Ag2CrO4 呈红色,可溶于水。有关物质的物理性质如下表:
熔点℃ | 沸点℃ | 溶解性 | |
CH3OH | -9 | 64.7 | 与水互溶 |
水合肼(N2H4H2O) | 2 | 113.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯(CH3ONO) | -17 | -12 | 难溶于水,可溶于乙醇、乙醚 |
NaN3 | 275 | 300 | 易溶于水,难溶于乙醇 |
请回答:
(1)步骤Ⅰ中NaNO2 与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为另一种气体)的离子方程式为_____;步骤Ⅱ中生成 NaN3 的化学方程式为_____
(2)实验室模拟步骤Ⅱ实验装置如图(装置中冷却水省略,下同):根据实验发现温度在 20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此需要采取的措施是_____。
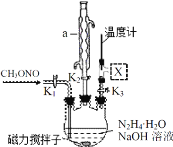
(3)步骤Ⅱ、Ⅲ中制备叠氮化钠并对溶液 A 进行蒸馏的合理操作顺序是_____。
①打开 K1、K2,关闭 K3 ②打开 K3 ③加热 ④关闭 K1、K2
(4)步骤Ⅳ对溶液B 加热蒸发至溶液体积的 1/3,NaN3 结晶析出。
①步骤Ⅴ最好选用_____洗涤晶体。
A.水 B.乙醇 C.乙醚
②沉淀滴定法测定产品纯度,是以淡黄色 K2CrO4 溶液作指示剂,将 AgNO3 标准溶液滴入样品溶液, 滴定终点现象为_________。AgNO3 溶液要装在_____滴定管里进行滴定。下列说法正确的是_____。
A.滴定管和移液管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若发现滴液过量,可回滴样品溶液
E.若未等滴定管液面稳定就读数会导致测定结果偏高
【答案】2NO2-+2H+==NO↑+NO2↑+H2O N2H4·H2O+CH3ONO+NaOH==NaN3+CH3OH+3H2O 冷水浴、缓慢通入气体 ①④②③或①②④③ B 溶液出现淡红色,半分钟内颜色不再改变 棕色酸式 BCE
【解析】
NaNO2、CH3OH与稀硫酸反应生成CH3ONO, N2H4·H2O、CH3ONO和NaOH反应生成 NaN3、CH3OH和H2O,经过蒸馏得到甲醇和NaN3溶液,再经过蒸发结晶过滤得到NaN3晶体,用乙醇洗涤晶体,防止洗涤时溶解。
⑴步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体,其中一种气体在空气中可以转化为另一种气体,说明是NO转变为NO2,其离子方程式为2NO2- + 2H+ = NO↑+NO2↑+H2O;步骤Ⅱ是N2H4·H2O、CH3ONO和NaOH反应生成 NaN3、CH3OH和H2O,其化学方程式为N2H4·H2O+CH3ONO+NaOH = NaN3+CH3OH+3H2O;故答案为:2NO2- + 2H+ = NO↑+ NO2↑ +H2O;N2H4·H2O+CH3ONO+NaOH = NaN3+CH3OH+3H2O。
⑵根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此要降低温度,适当减缓反应速率,因此需要采取的措施是冷水浴、缓慢通入气体;故答案为:冷水浴、缓慢通入气体。
⑶步骤Ⅱ、Ⅲ中制备叠氮化钠并对溶液A 进行蒸馏,先让N2H4·H2O、CH3ONO和NaOH反应生成NaN3,因此打开 K1、K2,关闭K3,充分反应后,关闭K1、K2,打开K3,再加热蒸馏出产品,因此合理操作顺序是①④②③或①②④③;故答案为:①④②③或①②④③。
⑷①NaN3晶体易溶于水,难溶于乙醇,步骤Ⅴ最好选用乙醇洗涤晶体;故答案为:B。
②沉淀滴定法测定产品纯度,是以淡黄色 K2CrO4 溶液作指示剂,将 AgNO3 标准溶液滴入样品溶液, 滴定终点现象为滴入最后一滴AgNO3溶液,溶液出现淡红色,半分钟内颜色不再改变。AgNO3 溶液显酸性且见光要分解,因此要装在棕色酸式滴定管里进行滴定;A. 当滴定接近终点时,滴定管或移液管尖嘴可接触锥形瓶内壁,让其充分反应,故A错误;B. 滴定时滴液速度应先快后慢,接近终点时一滴一摇,避免因滴加速度过快而过量,故B正确;C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下,让其充分反应,故C正确;D.若发现滴液过量,只能重新实验,故D错误;E.若未等滴定管液面稳定就读数,读出数据偏大,所测结果偏高,故E正确;综上所述,答案为BCE;故答案为:溶液出现淡红色,半分钟内颜色不再改变;棕色酸式;BCE。


科目:高中化学 来源: 题型:
【题目】人们对苯及芳香烃的认识有一个不断深化的过程,回答下列问题:
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为C6H6的一种含两个三键且无支链的链烃的结构简式________.
(2)已知分子式为C6H6的有机物有多种,其中的两种为:(Ⅰ)![]() 、
、![]() .
.
①这两种结构的区别表现在以下两方面:
定性方面(即化学性质方面):(Ⅱ)能________(填字母),而(Ⅰ)不能.
a.被高锰酸钾酸性溶液氧化 b.与溴水发生加成反应
c.与溴发生取代反应 d.与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6与H2加成时:(Ⅰ)需要H2________mol,而(Ⅱ)需要H2________mol.
②今发现C6H6还可能有一种如图所示的立体结构![]() ,该结构的二氯代物有________种.
,该结构的二氯代物有________种.
(3)萘也是一种芳香烃,它的分子式是C10H8,请你判断它的结构简式可能是________(填字母).
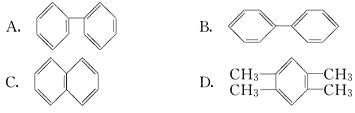
(4)现代化学认为,萘分子中碳碳键是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示4—溴环己烯所发生的4个不同反应。
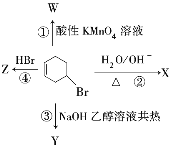
(1)其中产物中只含一种官能团的有__________、__________(填X、Y、Z、W),其官能团分别为____、____。
(2)①的反应类型为____,②的反应类型为____。
(3)根据图示归纳![]() 所具有的化学性质:____。
所具有的化学性质:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物X 转化为 Y 或 Z 的能量变化如图所示。下列说法正确的是
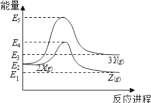
A.由X→Z反应的ΔH=E2-E1
B.反应2X(g) = 3Y(g)的活化能=E3-E2
C.2X(g) = Z(s) ΔH<E1-E2
D.由图可知,X(g)、Y(g)、Z(g)的稳定性情况为:Z(g)>X(g)>Y(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图。据图判断下列说法不正确的是( )
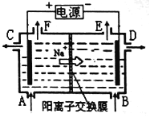
A.标准状况下,生成22.4LCl2的同时有2molNaOH生成
B.从C口流出的是NaOH溶液
C.从E口逸出的气体是H2
D.从F口逸出的气体是Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钇主要用于制造微波磁性材料、军工材料、光学玻璃和显像管涂料等。工业上通过如下工艺流程用钇矿石(Y2 FeBe2 Si2O10,Y的化合价为+3)制取氧化钇。
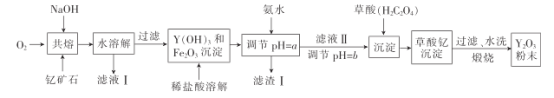
已知:i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.3 |
(1)用氧化物的形式表示Y2 FeBe2 Si2O10为___, 钇矿石在熔融前要粉碎,目的是___。
(2)共熔时通人氧气的作用是_________。
(3)滤液I中溶质的主要成分是___ ( 假设钇矿石恰好与NaOH完全反应)。
(4)用氨水调节pH=a时,a的取值范围是_____,设计实验证明滤渣I沉淀完全: _______________。
(5)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“异丙苯氧化法”生产丙酮和苯酚的合成路线如下,各反应的原子利用率均为100%。下列说法正确的是
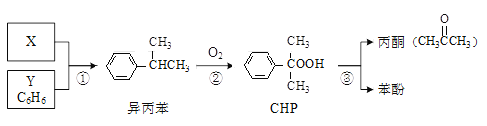
A. X的分子式为C3H8B. Y与异丙苯可用酸性KMnO4溶液鉴别
C. CHP与CH3COOH含有相同的官能团D. 可以用分液的方法分离苯酚和丙酮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素锰(Mn)在溶液中主要以Mn2+(近无色)、MnO4-(紫红色)、MnO42-(绿色)等形式存在,MnO2(棕黑色)、MnCO3(白色)为难溶于水的固体。回答下列问题:
(1)盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可通过间接的方法推算。现根据下列3个热化学反应方程式:
①MnO2(s)+CO(g)=MnO(s)+CO2(g) H=﹣150.6kJ/mol
②Mn3O4(s)+CO(g)=3MnO(s)+CO2(g) H=﹣54.4kJ/mol
③3Mn2O3v+CO(g)=2Mn3O4(s)+CO2(g) H=﹣142.3kJ/mol
写出CO气体还原MnO2固体得到Mn2O3固体和CO2气体的热化学反应方程式:_________
(2)①一定温度下,在5L的密闭容器中放入足量碳酸锰(固体所占体积忽略不计)发生反应:MnCO3(s)![]() MnO(s)+CO2(g),若前2min 内生成MnO的质量为7.1 g,则该段时间内v(CO2)=____________mol·L-1·min-1。
MnO(s)+CO2(g),若前2min 内生成MnO的质量为7.1 g,则该段时间内v(CO2)=____________mol·L-1·min-1。
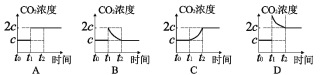
②保持温度不变,若t0时刻达到平衡时,CO2浓度为cmol/L;t1时刻,将容器体积缩小为原来的一半并固定不变,在t2时刻再次达到平衡,则下列图像正确的是_____(填字母)。
(3)已知Fe3+、Al3+、Mn2+的氢氧化物开始沉淀及沉淀完全时的pH如下表所示,当Al3+完全沉淀时,若要使Mn2+不沉淀,则Mn2+的最大浓度为_______________。(已知:Ksp[Mn(OH)2] = 1.9×1013)
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
开始沉淀pH | 1.8 | 4.1 | 8.3 |
完全沉淀pH | 3.2 | 5.0 | 9.8 |
(4)高锰酸钾在不同的条件下发生的反应如下:
MnO4-+5e-+8H+==Mn2++4H2O
MnO4-+3e-+2H2O==MnO2↓+4OH-;
MnO4-+e-==MnO42-
①从上述三个半反应中可以得出的结论是_______________。
②将SO2通入高锰酸钾溶液中,观察到的现象是________。
(5)向酸性高锰酸钾溶液中加入草酸溶液,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是_______________,写出反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
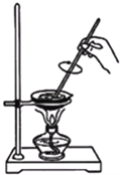
【题目】制取肥皂的实验有以下步骤:
①在一个干燥的蒸发皿中加入植物油8mL、乙醇8mL、NaOH溶液4mL
②在不断搅拌下,给蒸发皿中液体微微加热,直到混合物变稠
③继续加热,直到皂化反应完成
④把盛混合物的蒸发皿放在冷水浴中冷却.等待片刻,向混合物中加20mL热蒸馏水,再放在冷水中冷却.然后加入25mL NaCl饱和溶液充分搅拌
⑤用纱布滤出固体物质,弃去滤液.把固体物质挤于、压成条状、晾干,即得肥皂
根据实验,填空:
(1)在制肥皂时加入乙醇是利用了乙醇的什么性质?_________;
(2)如何验证皂化反应已完成?_________;
(3)在操作④中加入饱和NaCl溶液的作用是_________;
(4)写出硬脂酸甘油酯发生皂化反应的化学方程式_________;
(5)取用蒸发皿用的仪器是_________;
(6)工业上大规模生产用水蒸气加热的优点_________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com