
【题目】(1)已知葡萄糖完全氧化放出的热量为2804KJ·mol—1,当氧化生成1g水时放出________;液态的植物油经过________可以生成硬化油,天然油脂大多由_________________组成,油脂在________条件下水解发生皂化反应,酸败的油脂往往具有__________;坏血病是缺乏________________所引起的,铁是________________的主要组成成分,对维持人体所有细胞正常的生理功能是十分必要的。
(2)维生素按不同的溶解性可分为_________________和水溶性维生素两大类,其中水溶性维生素包括__________和__________族。
【答案】 26kJ 氢化 混甘油脂 强碱 哈喇味 VC 血液红细胞 脂溶性维生素 维生素C 维生素B族
【解析】(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,葡萄糖的燃烧热是2804kJ/mol,说明1mol葡萄糖完全燃烧生成二氧化碳气体和液态水放出2804kJ的热量,则反应的热化学方程式为C6H12O6(g)+6O2(g)=6CO2(g)+6H2O(l) △H=-2804KJ/mol,
1gH2O(l)的物质的量为 ![]() mol,则当它氧化生成1gH2O(l)时放出的热量是
mol,则当它氧化生成1gH2O(l)时放出的热量是![]() mol×
mol×![]() ×2804kJ/mol=26kJ;植物油中含有碳碳双键,能加成得到硬化油;天然油脂大多由混甘油酯组成;油脂在强碱性条件下的水解称为皂化反应;酸败的油脂往往具有哈喇味;坏血病是缺乏VC所引起的,铁是血液红细胞的主要组成成分,对维持人体所有细胞正常的生理功能是十分必要的;(2)维生素按不同的溶解性可分为脂溶性维生素和水溶性维生素两大类,其中水溶性维生素包括维生素C和维生素B族族。
×2804kJ/mol=26kJ;植物油中含有碳碳双键,能加成得到硬化油;天然油脂大多由混甘油酯组成;油脂在强碱性条件下的水解称为皂化反应;酸败的油脂往往具有哈喇味;坏血病是缺乏VC所引起的,铁是血液红细胞的主要组成成分,对维持人体所有细胞正常的生理功能是十分必要的;(2)维生素按不同的溶解性可分为脂溶性维生素和水溶性维生素两大类,其中水溶性维生素包括维生素C和维生素B族族。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,硝酸既表现酸性,又表现氧化性的是
A. Fe2O3跟稀硝酸反应 B. Fe(OH)2跟稀硝酸反应
C. CuO跟稀硝酸反应 D. Al(OH)3跟稀硝酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:

(1)此流程的第II步反应为:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 830 |
平衡常数K | 10 | 9 | 1 |
从上表可以推断:此反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H2O,则达到平衡后CO的转化率为 。
(2)在500℃,按照下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是 。
实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
A | 1、1、0、0 | c1 | Q1 | α1 |
B | 0、0、2、2 | c2 | Q2 | α2 |
C | 2、2、0、0 | c3 | Q3 | α3 |
A.2c1= c2 =c3 B.2Q1=Q2=Q3 C.α1 =α2 =α3 D.α1 +α2 =1
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是 。
①v(CO2)正=v(H2O)逆
②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件使浓度发生变化的情况:图中t2时刻发生改变的条件是 、 (写出两种)。
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
①CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
②CO(g)+1/2O2(g)![]() CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1
③H2(g)+1/2O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2 (g)![]() CH3OH(g) ΔH=________ kJ·mol-1。
CH3OH(g) ΔH=________ kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号)。
a. 使用高效催化剂 b. 降低反应温度
c. 增大体系压强 d. 不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_______;
③100℃时,达到平衡后,保持压强P1不变的情况下,再向容器中通入CO、H2和CH3OH各0.5a mol,则平衡_______ (填“向右”、“向左”或“不”移动)。
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1- T2及T4- T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤) 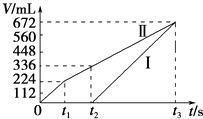
(1)原混合溶液中CuSO4的物质的量浓度.
(2)电解至t3时,消耗水的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表和元素周期律对化学学习具有指导意义,下列有关叙述正确的是( )
A. 铅位于周期表中金属与非金属元素交界处,可做半导体材料
B. 若存在简单阴离子R2-,则R一定属于第ⅥA族元素
C. S和Se属于第ⅥA族元素,H2S还原性比H2Se的强
D. 元素原子最外层电子数较少的金属一定比最外层电子数较多的金属活动性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 mol甲烷和4mol氯气组成的混合气体充入到大试管中将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,一段时间后,推测可能观察到的现象
①黄绿色逐渐消失
②试管壁上有油珠
③试管内水面上升
④水槽内有少量晶体析出
A.只有①③ B.只有①②③ C.只有①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5molL﹣1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图. 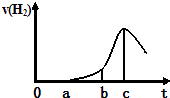
(1)下列关于图像的说法不正确的是(填序号,下同); ①a→b段产生H2加快可能是表面的氧化膜逐渐溶解,加快了反应速率
②b→c段产生H2较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生H2速率逐渐下降可能是铝片趋于消耗完全
(2)其他条件不变,现换用500mL 1molL﹣1盐酸,产生氢气速率普遍较使用500mL 0.5molL﹣1硫酸的快,可能的原因是; ①盐酸中c(H+)的浓度更大 ②Cl﹣有催化作用 ③SO42﹣有催化作用
④SO42﹣有阻化作用(使反应变慢) ⑤Al3+有催化作用
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②加入蒸馏水;③将铝片换成铝粉;④增加硫酸的浓度至18mol/L;⑤;⑥ . 以上方案不合理的有;请你再补充两种合理方案,填入空白⑤⑥处.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列溶液中水的电离程度最小的是
A.0.01 mol/L 醋酸溶液B.0.01 mol/L NH4Cl 溶液
C.0.01 mol/L NaHSO4 溶液D.0.01 mol/L NaHCO3 溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com