
 A是自然界存在最广泛的第ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由图表示:
A是自然界存在最广泛的第ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由图表示: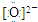 ,故答案为:Ca2+
,故答案为:Ca2+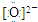 ;
; 

 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:

| A、当有0.1mol电子转移时,a极产生1.12L O2(标准状况下) |
| B、b极上发生的电极反应是:4H2O+4e-═2H2↑+4OH- |
| C、c极上发生的电极反应是:O2+4H++4e-═2H2O |
| D、d极上进行还原反应,B中的H+可以通过隔膜进入A |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示的装置进行电解.A中盛有足量CuSO4溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.A中盛有足量CuSO4溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的d区,且原子序数是d区中最大的.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的d区,且原子序数是d区中最大的.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com