
 A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图图,据此填空:
A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图图,据此填空:分析 A、B、C、D四种短周期元素,由A的电子排布可知x=2,则A的电子排布2、8、4,故A为硅(Si)元素;C、B同主族,B、C可形成共价化合物BC3和BC2,可知B为S元素,C为O元素;A、B、D为相邻的同周期元素,则D为P元素,据此进行解答.
解答 解:A、B、C、D四种短周期元素,由A的电子排布可知,x=2,故A的电子排布2、8、4,故A为硅(Si)元素;C、B同主族,B、C可形成共价化合物BC3和BC2,可知B为S元素,C为O元素;A、B、D为相邻的同周期元素,故D为P元素,
(1)由上述分析可知,A为硅元素,其气态氢化物的化学式为 SiH4,
故答案为:硅; SiH4;
(2)同周期自左而右原子半径逐渐减小,则原子半径Si>P>S,同主族自上而下原子半径增大,故原子半径S>O,所以原子半径半径由小到大的顺序为:O<S<P<Si,
故答案为:O<S<P<Si;
(3)B为S元素,最高价为+5价,则其最高价氧化物对应水合物的化学式为:H2SO4;D为P元素,最高正化合价为+5,最高价氧化物的水化物化学式为H3PO4,
故答案为:H2SO4;H3PO4.
点评 本题考查位置结构性质的相互关系,题目难度中等,推断元素为解答关键,明确原子核外电子排布规律为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | 提出问题 | B. | 获得结论 | C. | 猜想 | D. | 反思 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学方程式 | F2+H2?2HF | H2+Cl2?2HCl | H2+Br2(g)?2HBr | H2+I2(g)?2HI(g) |
| 平衡常数K(t1) | 1.8×1036 | 9.7×1012 | 5.6×107 | 43 |
| 平衡常数K(t2) | 1.9×1032 | 4.2×1011 | 9.3×106 | 34 |
| A. | 只有ab | B. | 只有abe | C. | 只有abce | D. | abcde |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应是放热反应还是吸热反应,由生成物与反应物的焓值差决定 | |
| B. | 升高温度,可以改变化学反应的反应热 | |
| C. | △H的大小与热化学方程式中的化学计量数无关 | |
| D. | 1 mol H2在足量Cl2中完全燃烧所放出的热量,是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 一个化学反应的△H与实际参加化学反应的物质的多少无关,而与热化学方程式的计量系数有关 | |
| C. | 中和热测定实验中,将碱溶液分多次缓慢加入酸溶液中可减小实验误差 | |
| D. | 在海轮外壳连接锌块保护外壳不受腐蚀采用的是牺牲阳极的阴极保护法,属于电解原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
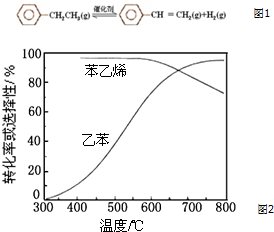 乙苯催化脱氢制苯乙烯反应如图1:
乙苯催化脱氢制苯乙烯反应如图1:| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | X | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔比1:1 | B. | 摩尔比1:2 | C. | 质量比1:1 | D. | 质量比7:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com