
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器可将汽车尾气中主要污染物转化为无毒的大气循环物质。已知:
①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
②C和CO的燃烧热(△H)分别为-393.5 kJ/mol和-283 kJ/mol
则2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=_______ kJ/mol。
(2)将 0.20 mol NO 和 0.10 mol CO充入一 个容 积 为 1L 的密闭容器中,反应过程中物质浓度变化如图所示。

①0~9 min 内 的平均反应速率v(N2)=____mol/(L ·min) (保留两位有效数字);第12min时改变的反应条件可能为_____ (填字母).
A.升高温度 B.加入NO C.降低温度 D.加催化剂
②该反应在第24min时达到平衡状态,CO的体积分数为____(保留三位有效数字),化学平衡常数K=_______(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表可)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol/LHCOONa溶液的pH=10,则HCOOH 的电离常数Ka=_______。
【答案】 -746.5 2.2×10-3 C 14.8% 3.4 2c(SO32-)+c(HSO3-) 1.0×10-7
【解析】(1)①N2(g)+O2(g)═2NO(g)△H1=+180.5kJmol-1,②C的燃烧热(△H)为-393.5kJmol-1,热化学方程式为C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1,③CO的燃烧热283kJmol-1 ,热化学方程式为CO(g)+ ![]() O2(g)=CO2(g)△H=-283kJmol-1,依据盖斯定律计算③×2-①得到,2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=-746.5kJ/mol,故答案为:-746.5;
O2(g)=CO2(g)△H=-283kJmol-1,依据盖斯定律计算③×2-①得到,2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=-746.5kJ/mol,故答案为:-746.5;
(2)①图像分析一氧化碳浓度变化=0.10mol/L-0.06mol/L=0.04mol/L,CO在0-9min内的平均反应速率v(CO)= ![]() =4.4×10-3 mol/(L·min),则v(N2)=
=4.4×10-3 mol/(L·min),则v(N2)= ![]() v(CO)=2.2×10-3 mol/(L·min),第12min时,一氧化碳和一氧化氮浓度减小,浓度增大说明平衡正向进行;A.反应是放热反应,升高温度,平衡逆向进行,故A不符合;B.加入NO,平衡正向进行,一氧化氮浓度大于原平衡,故B不符合;C.反应是放热反应,降低温度,平衡正向进行,故C符合;D.加催化剂改变反应速率不改变化学平衡,故D不符合;故答案为:2.2×10-3;C;
v(CO)=2.2×10-3 mol/(L·min),第12min时,一氧化碳和一氧化氮浓度减小,浓度增大说明平衡正向进行;A.反应是放热反应,升高温度,平衡逆向进行,故A不符合;B.加入NO,平衡正向进行,一氧化氮浓度大于原平衡,故B不符合;C.反应是放热反应,降低温度,平衡正向进行,故C符合;D.加催化剂改变反应速率不改变化学平衡,故D不符合;故答案为:2.2×10-3;C;
②该反应在第24min时达到平衡状态,平衡浓度c(N2)=0.03mol/L,c(NO)=0.14mol/L,c(CO)=0.04mol/L,依据化学平衡三段式列式计算
2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol/L) 0.2 0.1 0 0
变化量(mol/L) 0.06 0.06 0.03 0.06
平衡量(mol/L) 0.14 0.04 0.03 0.06
CO的体积分数=![]() ×100%=14.8%,平衡常数K=
×100%=14.8%,平衡常数K=![]() =3.4,故答案为:14.8%;3.4;
=3.4,故答案为:14.8%;3.4;
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,依据溶液中电荷守恒分析,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(H+)=c(OH-),得到c(Na+)=2c(SO32-)+c(HSO3-),故答案为:2c(SO32-)+c(HSO3-);
(4)常温下,0.1mol/L的HCOONa溶液pH为10,溶液中存在HCOO-水解HCOO-+H2OHCOOH+OH-,故Kh=![]() =10-7,则HCOOH的电离常数Ka=
=10-7,则HCOOH的电离常数Ka=![]() =
==1×10-7,故答案为:1.0×10-7。


科目:高中化学 来源: 题型:
【题目】被誉为“太空金属”的钛(Ti),在自然界中主要以金红石(TiO2)的形式存在.由于金红石熔点高,为金属Ti的直接制备带来了困难.在工业上常常采用将其先转化成熔沸点较低的TiCl4后再进行还原的方法.金红石转化成TiCl4的反应方程式如下:
TiO2+2C+2Cl2═TiCl4+2CO
(1)指出该反应的氧化剂 ,氧化产物 ;
(2)用双线桥法标出电子转移;
(3)当有6mol电子转移,则有 mol还原剂被氧化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是从元素周期表中截取下来的,甲、乙、丙为短周期主族元素,下列说法中正确的是( )
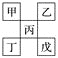
A. 丁一定是金属元素,其金属性比丙强
B. 丙的最高价氧化物水化物显强酸性
C. 乙的氢化物是以分子形式存在,且分子间存在氢键
D. 戊的原子序数一定是甲的5倍,且原子半径比甲大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol H2O2分子中含极性共价键数目为0.3 NA
B. 31g白磷中含有的P-P键数目为NA
C. 标况下22.4L戊烷含有分子数目大于NA
D. 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

A. a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH![]() )
)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在透明溶液中能大量共存的一组离子是( )
A.NH4+、Ba2+、Br-、CO32-B.Cl-、S2-、Fe2+、H+
C.Na+、H+、NO3-、HCO3-D.K+、Na+、SO42-、MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题.
(1)久置的硅酸钠溶液会出现浑浊现象其原因为________(用化学方程式表示)
(2)红热的木炭与浓硫酸反应的化学方程式________
(3)SO2催化氧化成SO3的化学方程式:________
(4)写出铜与稀硝酸反应的离子方程式________
(5)实验室制取氨气的化学方程式为 ________,常用________来干燥氨气.
(6)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是_______.
②氧化剂与氧化产物的物质的量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列电解质溶液,有关叙述正确的是( )
A. 等物质的量浓度的NaCl和AlCl3混合液完全电解后,所得的混合液的pH值增大
B. NaCl溶液电解一定时间后,要恢复到电解前状态,应加入适量盐酸
C. Na2SO4溶液在电解过程中,阴极区pH值降低
D. 电解CuSO4溶液,阳极反应式为:2H2O+O2+4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com