
����Ŀ�����̾�������Ҫ��������Դ������Ҫ�ɷ�ΪMnO2�������ʣ����û�������Ҫ�ɷ�ΪFeS2)����ʵ���̺����ķ��롣��������������£�

(1)�����Ԫ�ؽ����ʵĴ�ʩ(��д����)___________��
(2)����1�У�������ת��Ϊ���κ������Σ���д��������Ӧ�Ļ�ѧ����ʽ___________��
(3)�ӹ�ҵ�����ɱ����ǣ������A�����______________��
A.CaCO3 B.NaOH C.��ˮ D.Ca(OH)2
�Ƚ���Һ2����Ҫ�ɷ�Ag(CN)2-��д������2�з�����Ӧ�����ӷ���ʽ________���������Һ�У�����ѭ�����õ�����_______(�ѧʽ)��
(5)��ͼ��֪����Һ�̱�(ˮ����ϵ�������)����5ʱ�������ʷ������͵�ԭ��________��

(6)���̿��У�������������״��ɢ��MnO2�����У����ƻ�ԭ�нṹ��������������̵Ľ�������������ȡ��������Ҫ��ijС��ͨ��ʵ�飬�о�����������������������(ռ���ذٷֱ�)���̽����ʵ�Ӱ�죬�����ʾ��
���ᣥ | 31.52 | 36.10 | 40.67 | 45.25 |
�̽����� | 77.42 | 89.49 | 91.59 | 97.95 |
������ | 12.5 | 15 | 17.5 | 20 |
�̽����� | 88.79 | 97.95 | 99.18 | 99.46 |
��ʵ�������Ƕȳ������±�����������������ѵ���________��
A | ����45.25% | B | ����31.52% | C | ����45.25% | D | ����36.10% |
������20% | ������15% | ������15% | ������20% |
���𰸡� ���� �����顢��ֽ���ȣ����������𰸸��֣� 2FeS2 + 15MnO2 + 14H2SO4 = Fe2(SO4)3 + 15MnSO4 + 14H2O A 4Ag + O2 +8CN- + 2H2O = 4 Ag(CN)2- + 4OH- NaCN����CN-�� NaCN Ũ�Ƚ��ͣ���ȡ���ʵ� C
��������(1)����ͨ�����ȡ����顢��ֽ���ȴ�ʩ�����Ԫ�ؽ����ʣ�
(2)MnO2��FeS2�ܽ���������Һ���õ��������������̣����ݵ����غ㼰ԭ���غ�ɵô˷�Ӧ�Ļ�ѧ����ʽΪ2FeS2 + 15MnO2 + 14H2SO4 = Fe2(SO4)3 + 15MnSO4 + 14H2O ��
(3)CaCO3��NaOH����ˮ��Ca(OH)2���ܵ�����Һ��pH�������ɳɱ��Ƕȿ��ǣ�ʹ�óɱ�CaCO3��ͣ��ʴ�ΪA��
��Ag���������������ܽ���NaCN��Һ������Ag(CN)2-�����ݵ����غ㡢����غ㼰ԭ���غ�ô˷�Ӧ�����ӷ���ʽΪ4Ag + O2 +8CN- + 2H2O = 4 Ag(CN)2- + 4OH- ��������Һ�������Ϸ����缫��ӦΪ Ag(CN)2- + e- =Ag+2CN-������õ���NaCN��Һ��ѭ�����ã�
(5)Һ�̱�Խ��NaCN��Ũ�Ƚ��ͣ���ȡ���ʵ� ��
(6)��ͼ����֪����������������״��ɢ��MnO2�����У����ƻ�ԭ�нṹ��������������̵Ľ�����Խ����������ҲԽ�ߣ��������Ũ��Ϊ45.25����������20��ʱ�̽����ʴ����ֵ����ʵ�������Ƕȳ�������ѽ�������������45.25%��������15%������ΪC��


 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�C��s��+ H2O��g�� ![]() CO+ H2��g����H>0 ��һ�ݻ��̶����ܱ������з��������Ľ�̿��һ������ˮ�������з�Ӧ�������й�ͼ����ȷ����
CO+ H2��g����H>0 ��һ�ݻ��̶����ܱ������з��������Ľ�̿��һ������ˮ�������з�Ӧ�������й�ͼ����ȷ����
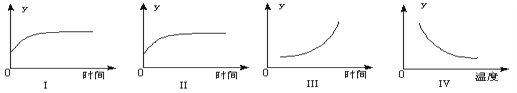
A. ��ͼ��ʾ��Ӧ���й���������ƽ����Է��������ı仯
B. ��ͼ��ʾ��Ӧ���й����������ܶȵı仯
C. ��ͼ��ʾ��Ӧ�ﵽƽ�����ȥ��̿��ˮ�����İٷֺ����ı仯�����Ա������Ӱ�죩
D. ��ͼ��ʾ��Ӧ�ﵽƽ��������¶�CO�İٷֺ����ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪCH4ȼ�ϵ�ص�װ�ã�A��BΪ���̼������

��1��_____����A��B�����缫���ͨ���飬��缫��ӦʽΪ_____________��
��2�������ļ�������Ϊ11.2 L����״���£�ʱ������KOH������Ϊ_______g��
��3��Ǧ����������ʹ�õij���أ���Pb��PbO2�����ṹ�ɡ��õ�ع���ʱ�������ĵ缫��ӦΪ____________________��
��4��500 mL KNO3��Cu(N03)2�Ļ����Һ��c(NO3��)��6��0 mol��L��1����ʯī���缫������Һ����ͨ��һ��ʱ����������ռ���22��4 L���壨��״�������ٶ�������Һ�����Ϊ500 mL��ԭ�����Һ��c(K��)Ϊ_________mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ռ�Ӧѡ�õ��������� ��
A. ʯӢ���� B. �������� C. ��ͨ�������� D. �մ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�ͭ��һ�ֹ㷺�����������ϡ�ľ�ķ������ȵĻ�����Ʒ����ҵ���ô�����ͭ����Fe2O3��FeO��Cu2O�Լ��������������ʣ�Ϊԭ����ȡ�Ȼ�ͭ���� ��CuCl2��2H2O����Ϊ�����������£�

��֪��Cu2O�����Ի����п�������Cu2+��Cu �ش��������⣺
��1����֪���������в���ͭ���ʣ�д��Cu2O�ڡ�����������з�����Ӧ�Ļ�ѧ����ʽ��___________________________________________
��2��������������У�ͭ�Ľ����������ʱ��Ĺ�ϵ����ͼ��ʾ����ͼ�ɵó����±仯���ɣ�

��____________________________
��______________________________��
��3�����������ӡ����ȼ���C1O2���������ǣ������ӷ���ʽ��ʾ��______________��
Ȼ���ٵ�����Һ��pHԼΪ4����ѡ�õ��Լ��ǣ���ѡ����ĸ��______________��
A. CuSO4 B.CuO C.Cu2(OH)2CO3 D.NH3��H2O
��4��������I�������ಽʵ�����������������__________��ϴ�Ӻͷ�ɵȡ���ҵ�ϳ�������ˮ�Ҵ�����ˮ����ϴ�ӵ���Ҫԭ����______________��
��5��Ϊ�˲ⶨ�Ƶõ��Ȼ�ͭ����(CuCl2��xH2O)��xֵ����ȡag���壬��������10%������������Һ�����ˡ�ϴ�Ӻ��þƾ��Ƽ������������ټ���Ϊֹ����ȴ���������ù�������Ϊbg�������x= ______________�����ú�a��b�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ؿ��к���ռ��һ����λ��Ԫ��֮���γɵĻ����ﲻ���е������ǣ� ��
A. ��������ˮ��Ӧ������ B. ����ʱ����CaO��CaCO3��Ӧ
C. ��������������Ʒ�Ӧ D. ����ʱ��������ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ѧ��Fulvio Cacace���˻���˼��������о������N4���ӡ�N4���ӽṹ����ͼ��ʾ����֪����1mol N��N������167kJ����������1mol N��N�ų�942kJ����������������Ϣ�����ݣ�����˵����ȷ����
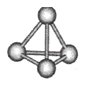
A. N4����һ�����͵Ļ�����
B. N4��N2��Ϊͬ��������
C. N4�е��P4�����ף���
D. 1molN4����ת��ΪN2������882kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ������ʵ���������������������Ӧ���ų����������ʵ���������
A������������Һ B��ϡ���� C������������Һ D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����6�����ʣ��ټ��� �ڱ� �۾���ϩ ����ϩ �ݱ�ϩ ���飬����ʹ���Ը��������Һ��ɫ��������ˮ�����ӳɷ�Ӧʹ֮��ɫ���ǣ� ��
A. �ۢܢ�B. �ܢ�C. �ܢݢ�D. �ۢܢݢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com