
【题目】在容积固定容器中,发生反应2HI(g)![]() H2(g)+I2(g), 下列方法中能证明已达到平衡状态的是( )
H2(g)+I2(g), 下列方法中能证明已达到平衡状态的是( )
①混合气体的颜色不再变化 ②![]() 各组分浓度相等 ③
各组分浓度相等 ③![]()
④一个H-H键断裂的同时有两个H-I键断裂 ⑤混合气体的平均摩尔质量不再变化
A. ①④ B. ①②④ C. ①③⑤ D. ①④⑤
【答案】A
【解析】分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
详解:①容器内气体颜色不再变化,说明碘的浓度不变,正逆反应速率相等,正确;
②各组分浓度相等,但相等并不是不变,不能说明反应达到平衡状态,错误;
③反应速率v正(H2)=2v逆(HI),而速率之比与计量数不成比例,反应没有达到平衡状态,错误;
④一个H-H键断裂等效于两个H-I键形成的同时有两个H-I键断裂,说明正逆反应速率相等,反应达到平衡状态,正确;
⑤混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量均是不变,所以混合气体的平均摩尔质量不再变化不能说明反应达到平衡状态,错误;所以①④正确;答案选A。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】下列关于酶的叙述,不正确的是 ( )
A. 绝大多数酶的化学本质是蛋白质
B. 酶催化的化学反应一般是在比较温和的条件下进行的
C. 能够催化脂肪酶水解的酶是脂肪酶
D. 酶的催化效率高是因为其降低活化能的效果显著
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一原电池的结构示意图,下列说法中,错误的是( ) 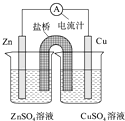
A.Cu电极为正电极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂﹣饱和KCl溶液)中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H1 =-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2 =+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为__________。
(2)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1 =-90kJ·mol-1 K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2 K2
己知:CO(g)+H2O(g)= CO2(g)+H2(g) △H3 =-41.1kJ·mol-1 K3
H2O(l)=H2O(g) △H4 =+44.0kJ·mol-1 K4
则△H2=______ K2=_______ (用含K1、K3、K4的代数式表示)
(3)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g) ![]() CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
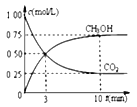
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________(用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______(填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
(4)甲醇可在电解银催化作用下制甲醛,从贵金属阳极泥中可提取“粗银”“粗银”(含Ag、Cu、Au)可用电解槽电解精炼,纯银作阴极,采用AgNO3和稀HNO3的混合液作电解液,阴极的主要电极反应式为_____。阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为_______。硝酸浓度不能过大,其原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾. 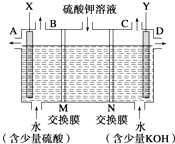
(1)X极与电源的(填“正”或“负”)极相连,氢气从(填“A”、“B”、“C”或“D”)口导出.
(2)离子交换膜只允许一类离子通过,则M为(填“阴离子”或“阳离子”)
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的反应式为 .
(4)若在标准状况下制得11.2L氢气,则生成硫酸的质量是 , 转移的电子数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃按一定比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中一定不符合此条件的是( )
A. CH4 C3H6 B. CH4 C2H4
C. C2H4 C3H4 D. C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述正确的是
选项 | 实验方案 | 实验目的或结论 |
A | 将一片铝箔置于酒精灯外焰上灼烧 | 通过现象铝箔熔化而不滴落证明铝箔只发生了物理变化 |
B | 用玻璃棒蘸取氯水滴到pH试纸上,对比标准比色卡颜色 | 通过颜色变化可测定氯水的pH |
C | 往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性KMnO4溶液中 | 通过现象KMnO4褪色可证明乙烯能被酸性高锰酸钾氧化 |
D | 取少量溶液于试管中,加入NaOH溶液并加热,用湿润红色石蕊试纸检验产生的气体 | 通过试纸变色情况可检验原溶液中是否含有NH4+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯
B.在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于苯环对侧链的影响,使侧链易被氧化
C.若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种
D.菲的结构简式为 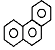 ,它与硝酸反应,可生成3种一硝基取代物
,它与硝酸反应,可生成3种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:HCHO(甲醛)、MgSO4、NH4Cl、Hg(NO3)2中,能使蛋白质变性的是( )
A.甲醛
B.MgSO4
C.NH4Cl
D.Hg(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com