


科目:高中化学 来源: 题型:
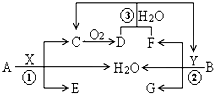 已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如图所示,其中D为红棕色气体,G溶液呈蓝色.
已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如图所示,其中D为红棕色气体,G溶液呈蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:
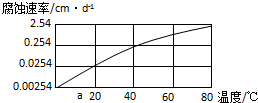
| 实验编号 | 金属材料 | 溶 液 | 实验目的 |
| ① | 铝合金 | CO2+H2O | Ⅰ.探究不同溶液对金属材料的腐蚀速率; Ⅱ.探究不同金属材料的腐蚀速率; |
| ② | |||
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
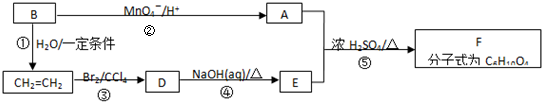
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
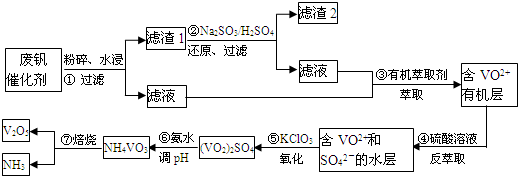
查看答案和解析>>
科目:高中化学 来源: 题型:
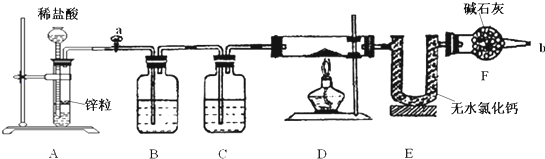
查看答案和解析>>
科目:高中化学 来源: 题型:
A、按系统命名法,化合物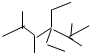 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 |
| B、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 |
| C、苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 |
D、结构片段为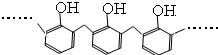 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H4 |
| B、C2H4O |
| C、C2H6 |
| D、C3H6O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com