
【题目】I.甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84 kJ/mol 2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol。工业上常以甲醇为原料制取甲醛,请写出 CH3OH (g)与O2 (g)反应生成HCHO(g)和H2O(g)的热化学方程式:_______________________。
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。该电池负极的电极反应式为________________。
Ⅱ.在2L密闭容器中,800℃时反应2NO(g)+O2 (g)![]() 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图所示,表示NO2变化曲线的是_______,用O2表示从0~2 s内该反应的平均速率v=_______。
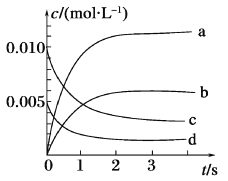
(2)能说明该反应已达到平衡状态的是_______(填序号)。
a.v(NO2) =2V(O2) b.容器内压强保持不变
c.体系颜色不再改变 d.容器内密度保持不变
【答案】 2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ΔH=-316 kJ·mol-1 CH3OH-6e-+8OH- = 6H2O b 1.25×10-3mol·(L·s)-1 bc
【解析】I.(1)已知①CH3OH(g)=HCHO(g)+H2(g) △H=+84 kJ/mol ;②2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol。由①![]() ②得2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g),ΔH=(+84 kJ/mol)
②得2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g),ΔH=(+84 kJ/mol)![]() +(-484 kJ/mol)= -316 kJ·mol-1。所以 CH3OH (g)与O2 (g)反应生成HCHO(g)和H2O(g)的热化学方程式为2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ΔH=-316 kJ·mol-1。
+(-484 kJ/mol)= -316 kJ·mol-1。所以 CH3OH (g)与O2 (g)反应生成HCHO(g)和H2O(g)的热化学方程式为2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ΔH=-316 kJ·mol-1。
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,电极反应为2CH3OH+3O2+4OH- = 2 CO32-+6H2O,正极的反应式为3O2+6 H2O +12e- =12OH-。该电池负极的电极反应式为CH3OH-6e-+8OH- = 6H2O。
Ⅱ.由表中数据可知,反应从正反应开始发生,NO的物质的量逐渐减小,到第3s达到平衡,NO的变化量为0.013mol,所以NO2的变化量也是0.013mol,NO2的平衡浓度是0.0065mol/L。
(1)表示NO2变化曲线的是b,用O2表示从0~2 s内该反应的平均速率v(O2)= ![]() v(NO)=
v(NO)= ![]() 1.25×10-3mol·(L·s)-1 。
1.25×10-3mol·(L·s)-1 。
(2)a.v(NO2) =2V(O2),不能说明正反应速率和逆反应速率相等;b.该反应是一个气体分子数减少的反应,所以容器内压强是一个变量,当容器内压强保持不变时反应达到平衡;c.反应混合物中只有二氧化氮是有色气体,当二氧化氮的浓度不再变化时,体系颜色就不再改变,反应达到平衡;d.在反应过程中气体的质量和体积都保持不变,所以容器内密度保持不变,无法判断反应是否达到平衡。综上所述,能说明该反应已达到平衡状态的是bc。


科目:高中化学 来源: 题型:
【题目】化合物A[KxFe(C2O4)y·zH2O,其中铁元素为+3价]是一种重要的光化学试剂。
(1)制备化合物A的实验流程如下:
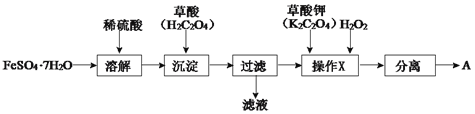
①上述流程中,检验“过滤”后的固体已洗涤干净的方法是____。
②上述流程“操作X”中加入H2O2的目的是____。
(2)测定化合物A的化学式实验步骤如下:
a、准确称取A样品4.91g,干燥脱水至恒重,残留物质的质量为4.37g;
b、将步骤a所得固体溶于水,加入还原铁粉0.28g,恰好完全反应;
c、另取A样品4.91g置于锥形瓶中,加入足量的3 mol/L的H2SO4溶液和适量蒸馏水,再加入0.50mol/L的KMnO4溶液24.0 mL,微热,恰好完全反应:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O。
请通过计算填空:
①4.91g A样品中含结晶水的物质的量为____mol。
②A样品中![]() =____。
=____。
③A的化学式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用如图所示装置对电解质溶液导电性进行实验探究.下列说法中正确的是( ) 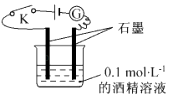
A.闭合开关K后,电流计 ![]() 指针不发生偏转,证明酒精溶液是非电解质
指针不发生偏转,证明酒精溶液是非电解质
B.闭合开关,往溶液中通入氯气,随着气体通入,电流计示数增大,故氯气是电解质
C.取用0.1 molL﹣1的蔗糖溶液替换酒精溶液,电流计的示数相同,说明蔗糖是非电解质
D.闭合开关,往烧杯中加NaCl固体,虽然固体溶解,由于不反应,故电流计指针不发生偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 组成不同生物体细胞的化学元素种类大体相同
B. 组成生物体细胞的大量元素为C、H、0、N、P、S
C. 组成细胞化合物的含量中蛋白质位于第二位
D. 组成人体细胞鲜重的前四位元素依次为0、C、H、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I. CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
II. 2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为______反应(填”吸热”’或”放热”)。
(2)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是____(填“a”或“b”)。
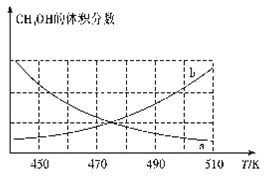
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
①0~4min,反应I的v(H2)=______,反应I的平衡常数K=______。
②反应II中CH3OH的转化率α=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关“骨架”的描述错误的是( )
A. 细胞膜的基本骨架是磷脂双分子层 B. 细胞骨架是蛋白质纤维组成的网架结构
C. 生物大分子都以碳链为骨架 D. DNA分子以碱基对为基本骨架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙在工农业生产中有广泛的用途。
(1)过氧化钙制备方法很多。
①制备方法一:H2O2溶液与过量的Ca(OH)2悬浊液反应可制备CaO2·8H2O,其化学方程式为:_________。
②制备方法二:利用反应Ca(s)+O2 ![]() CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
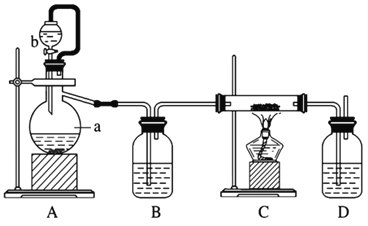
请回答下列问题:
装置A中反应的化学方程式为_________,仪器a的名称为 ________。装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是____________。
(2)水中溶氧量(DO)是衡量水体白净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1。测定原理为:
①碱性条件下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+4OH-=2MnO(OH)2↓;
②酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③用Na2S2O2标准溶液滴定生成的I2:2S2O32-+I2=S4O62-+2I-。
水产运输中常向水中加一定量CaO2·8H2O作供氧剂,取此水样100.0 mL,按上述方法测定水中溶氧量,消耗0.01000 mol/L Na2S2O2标准溶液13.50 mL。
滴定过程中使用的指示剂是________;该水样中的溶解氧量(DO)为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.稀的食盐水能杀死H7N9禽流感病毒
B.煤经过分馏和干馏两个物理变化,可变为清洁能源
C.电镀厂的废水直接用来灌溉农田,可提高水的利用率
D.用CO2合成聚碳酸酯可降解塑料,有利于减少白色污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com