
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
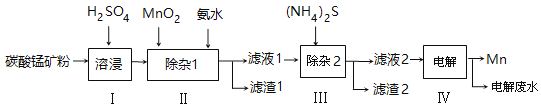
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该滤渣1所涉及的离子方程式为 、 。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+):c(Ni2+)= 。
(5)将质量为akg的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)
【答案】(1)升高温度、适当增大硫酸浓度、减小矿粉颗粒直径(或其他合理)(1分)(2)Fe(OH)3(1分)
2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O(2分) Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+(2分)
(3)若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失(1分)
(4)5:1 (2分)(5) ×100%(2分)
×100%(2分)
【解析】
试题分析:(1)升高温度、适当增大硫酸浓度、减小矿粉颗粒直径,可以加快溶浸速率;
(2)二氧化锰能够将亚铁离子氧化为铁离子,加入氨水生成氢氧化铁沉淀,其中MnO2将亚铁离子氧化的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,生成沉淀的离子方程式为Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+;
(3)步骤Ⅲ中所加(NH4)2S的浓度不宜过大否则会生成MnS沉淀,造成产品损失;
(4)滤液2中,c(Co2+):c(Ni2+)=![]() ;
;
(5)根据2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,加入二氧化锰的质量为![]() g,原碳酸锰矿中MnCO3的质量为
g,原碳酸锰矿中MnCO3的质量为![]() g,则原碳酸锰矿中MnCO3的质量分数为
g,则原碳酸锰矿中MnCO3的质量分数为 ×100%
×100%


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是

A.当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
B.当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D.当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池将是21世纪获得电能的重要途径。近几年开发的丁烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:

请回答下列问题:
(1)Pt(b)电极是电池的________极,电极反应式为_____________________________;Pt(a)电极发生________反应(填“氧化”或“还原”),电极反应式为____________。
(2)若电解质溶液改为KOH溶液,Pt(b)电极的电极反应式为_____________;Pt(a)电极的电极反应式为_____________________________________________________________。
(3)如果该电池工作时电路中通过1.2 mol电子,则消耗掉O2在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮等单质和化合物的反应有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H= -76.0 kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图如下:
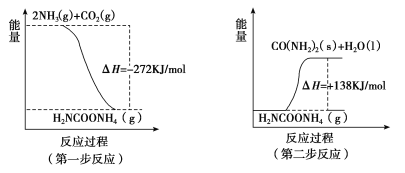
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为____________________。
(3)氨气在纯氧中燃烧,生成一种单质和水,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
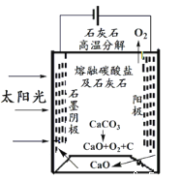
①上述生产过程的能量转化方式是_____________。
a、电能转化为化学能
b、太阳能转化为电能
c、太阳能转化为化学能
d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-,则阳极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是

A. 原电池的总反应为 Fe+Cu2+=Fe2++Cu
B. 反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子
C. 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑
D. 盐桥中是 KNO3溶液,则盐桥中NO3-移向乙烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:①SiO2 + 2C![]() Si + 2CO
Si + 2CO
精炼硅:②Si + 3HCl![]() SiHCl3 + H2
SiHCl3 + H2
③SiHCl3 + H2![]() Si + 3HCl
Si + 3HCl
化学反应与能量变化如图所示,回答下列问题:
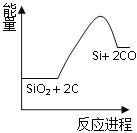
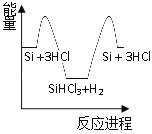
(1)反应①是_________反应(填“吸热”或“放热”),反应②是_________反应(填“吸热”或“放热”)。
(2)反应③破坏反应物中的化学键所吸收的能量_________形成生成物中化学键所放出的能量(填“大于”或“小于”)。
(3)研究物质变化时,人们可以从不同角度、不同层面来认识物质变化时所引起的化学键及能量变化。据此判断下列说法错误的是_________(双选)。
A.金属钠和氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低
B.等量的硫蒸气和硫固体分别完全燃烧,前者放出的能量多
C.氮气分子内部存在着很强的共价键,故通常状况下氮气的化学性质很活泼
D.由石墨制取金刚石是吸热反应,可知金刚石比石墨稳定
E.由放热反应H2 + Cl2 ==== 2HCl来说,断裂1mol H—H键和1molCl—Cl键所吸收的能量小于形成2molH—Cl键所放出的能量
(4)在研究化学反应中的能量变化时,我们通常做下面的实验:
在一个小烧杯里,加入20g已经研磨成粉末的氢氧化钡晶体【Ba(OH)2.8H2O】,将小烧杯放在事先已滴有3—4滴水的玻璃片上,然后向烧杯中加入约10gNH4Cl晶体,并立即用玻璃棒迅速搅拌。写出实验过程中发生反应的化学方程式_________,该反应中反应物总能量_________生成物的总能量(填“大于”或“小于”),实验过程中立即用玻璃棒迅速搅拌的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在催化剂作用下,CO2和H2可以制取甲醇.用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2![]() CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:

写出由二氧化碳和氢气制备甲醇的热化学方程式: .
(2)硼氢化钠(NaBH4)是有机合成中的重要还原剂.最新研究发现,以NaBH4(硼元素的化合价在该过程中不发生变化)和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:

电极b为 (填“正极”或“负极”),
电极a上发生反应的电极反应式为 .
(3)电池工作时,Na+向 极(填“a”或“b”)移动,
当左槽产生0.0125mol BO2﹣离子时,右槽溶液c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应,F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色,D能发生银镜反应,M与足量的NaOH溶液反应后的产物,其一氯代物只有一种。
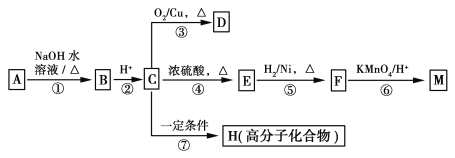
已知: (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)
请回答:
(1)B的结构简式为________________________。
(2)反应①~⑦中,属于氧化反应的是________(填反应序号)。
(3)写出反应④的化学方程式______________________________________________。
(4)D与新制Cu(OH)2悬浊液反应的化学方程式为______________________________。
(5)A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,下列确定该官能团的哪些实验方法是正确的________。
a.取少量A于试管中,再加入苯振荡,观察分液后上层溶液颜色
b.取少量A于试管中,再加入NaOH溶液共热,待冷却后加入稀硝酸调节至酸性,最后滴入AgNO3溶液,观察沉淀颜色
c.取少量A于试管中,再滴入AgNO3溶液,再加入稀硝酸,观察沉淀颜色
d.取少量A于试管中,再加入NaOH的醇溶液共热,待冷却后加入稀硝酸调节至酸性,最后滴入AgNO3溶液,观察沉淀颜色
(6)符合下列条件的F的同分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1∶1∶2∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)由乙烯制取聚乙烯的化学方程:_______________。
(2)写出下列物质的结构简式;
①2,3-二甲基戊烷____________________________________
②3-甲基-2-戊烯___________________________________
③间二甲苯____________________________
(3)分子中含有5个碳原子的链状单炔烃的分子式__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com