
【题目】下列离子方程式正确的是
A.NaOH溶液需要用胶塞试剂瓶盛装:SiO2+2Na++2OH-=Na2SiO3+H2O
B.铝与浓硫酸反应:2Al+6H+=2Al3++3H2↑
C.检验![]() 涉及的反应:
涉及的反应:![]() +OH-
+OH-![]() NH3·H2O
NH3·H2O
D.硫代硫酸钠与稀硫酸反应:![]() +2H+=S↓+SO2↑+H2O
+2H+=S↓+SO2↑+H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式如图,它属于( )

①芳香族化合物 ②脂肪族化合物 ③有机羧酸 ④有机高分子化合物 ⑤芳香烃
A. ③⑤ B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法制备碳酸氢钠的原理为NH3+H2O+CO2 +NaCl=NH4Cl+NaHCO3↓,某化学小组用如图装置在实验室中模拟该制备过程,下列说法不正确的是
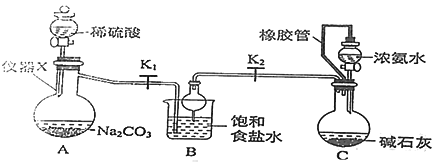
A. 装置A中仪器X的名称为蒸馏烧瓶
B. 装置B中球形干燥管的作用是防止倒吸
C. 装置C中橡胶管的作用是平衡压强,使溶液顺利滴下
D. 实验开始后,应先打开K1一段时间,然后再打开K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知I2+2S2O![]() ==S4O
==S4O![]() +2I- ,其中Na2S2O3溶液均足量,且S2O
+2I- ,其中Na2S2O3溶液均足量,且S2O![]() 与S4O
与S4O![]() 均为无色)
均为无色)
实验序号 | 体积V/mL | 蓝色褪去时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(1)表中Vx=_________mL,t1、t2、t3的大小关系是___________________
实验二:取5 mL 0.1 mol·L-1的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,发生如下反应:2Fe3++2I-=2Fe2+ +I2,为证明该反应存在一定的限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI)。
②再取少量反应液,滴加少量CCl4 ,振荡,发现CCl4层显浅紫色。
根据①②的现象,/span>他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度。
(2)指导老师指出上述实验①不合理,其原因是_______________ ; 你的改进方案是________(简要写出操作、试剂和现象)。
(3)实验②适合检验生成I2较多的情况,还有一种简便的方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是

A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物邻二乙烯苯广泛用于制造离子交换树脂,其结构简式如图所示,下列关于邻二乙烯苯的说法不正确的是
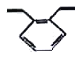
A.1 mol邻二乙烯苯含有5 mol碳碳双键
B.所有的原子可能在同一平面
C.能发生加成反应,也能发生取代反应
D.苯环上的二氯代物有4种(不考虑立体结构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员研制出透氧膜,它允许e-和O2-同时通过,可实现水连续分解制备氢气,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示,下列说法正确的是
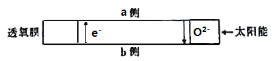
A.CO在a侧上反应
B.b侧的反应式:H2O+2e- = H2↑+ O2-
C.该透氧膜可实现太阳能向氢能的转化
D.当有2mol电子通过透氧膜时,就会消耗22.4L CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究KI与FeCl3的反应为可逆反应,且有一定的限度,某化学小组进行了两组实验:
(1)请写出KI溶液与FeCl3溶液反应的离子反应方程式:______;
实验I:探究KI与FeCl3的反应为可逆反应
步骤1:设计如下图原电池装置,接通灵敏电流计,指针向左偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
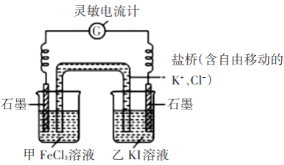
步骤2:当指针读数变零后,向甲中加入少量FeCl2固体,向乙中加入少量碘固体;
(2)若灵敏电流计出现_________(答现象),则证明该反应为可逆反应。实验结论:该反应为可逆反应。
(3)根据以上实验结论解释步骤1中“最后读数变为零”的原因_______;
(4)加入FeCl2和碘固体后,正极的电极反应式为______;
实验II:证明KI与FeCl3的反应有一定限度。
步骤3:取5 mL 0.1 mol/L的KI溶液于试管,滴加0.1 mol/L的FeCl3溶液2 mL,振荡;
步骤4:取少量反应后的溶液,向其中加入几滴淀粉溶液,充分振荡;
(5)观察到的现象是________;
步骤5:另取少量反应后的溶液,滴加0.1 mol/L的AgNO3溶液,振荡,产生黄色沉淀,则证明该反应有一定限度。
(6)但有同学认为步骤5现象不能证明得出的结论,原因是______,修正实验方案后得到结论:该反应有一定的限度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将无机碳转化为有机化合物是目前研究的热点,也是减少CO2和CO的有效措施之一,对环境的保护起到了积极作用。
I.二氧化碳催化加氢甲烷化工艺是利用氨还原CO2,反应为CO2(g)+4H2(g)![]() CH4(g)+2H2O(l)H1。
CH4(g)+2H2O(l)H1。
(1)已知:H2(g)的燃烧热H2=-285.8kJ·mol-1,CH4(g)的燃烧热H=-890.3kJ·mol-1,则△H1=________kJ·mol-1。
(2)测得该反应的吉布斯自由能(G=H-TS)随温度的变化曲线如图甲所示,为使CO2顺利转化为CH4,反应应在___下进行。
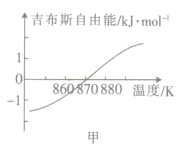
II.一氧化碳催化加氢制甲醇:CO(g)+2H2(g)![]() CH2OH(g)。
CH2OH(g)。
(3)图乙是反应中部分物质的浓度随时间t的变化情况,0~10min内,用H2表示的平均反应速率v(H2)=_____,该反应平衡常数的表达式为_______________。
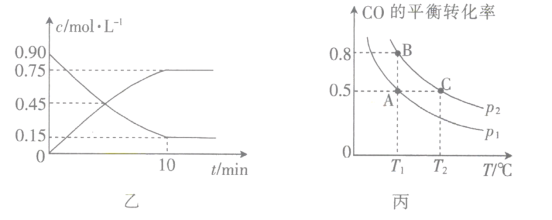
(4)在容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图丙所示。
①p1______(填“>”“<”或“=”)p2。
②比较图丙中A、C两点,平衡常数KA__________(填“>”“<”或“=")KC。
③若达到化学平衡状态点A时,容器的体积为20L,T1℃时平衡常数KA=______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com