
| A.Fe2+的水溶液为浅绿色 |
| B.Fe3+的水溶液为黄色 |
| C.Fe3+具有氧化性,Fe2+具有还原性 |
| D.Fe3+溶液中滴入含SCN-的溶液,立即出现红色沉淀 |
 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源:不详 题型:填空题
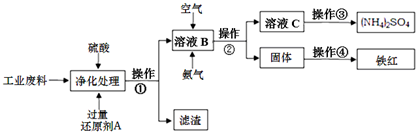
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
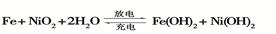
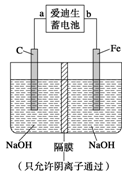
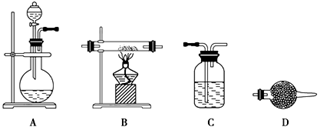
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
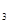 的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题: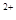 、Cu
、Cu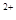 时,则b的取值范围是(用a、x表示)___________。
时,则b的取值范围是(用a、x表示)___________。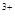 与Fe
与Fe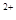 的物质的量相等时,在标准状况下共产生672 mL气体。则a=____________、b=_____________。
的物质的量相等时,在标准状况下共产生672 mL气体。则a=____________、b=_____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在潮湿的空气中放置不易生锈 |
| B.硬度比生铁小 |
| C.与3 mol/L盐酸的反应生成氢气 |
| D.与18.4 mol/L的硫酸反应生成氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| C | Si | Mn | P | S |
| 4.070% | 2.900% | 0.495% | 0.165% | 0.010% |
| | FeO | Fe2O3 | CaO |
| 烟尘煅烧前(%) | 86.40 | 4.00 | 9.60 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
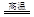 6Cu+SO2
6Cu+SO2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com