
【题目】以下关于甲烷的说法中错误的是( )
A.甲烷分子具有正四面体结构
B.甲烷化学性质比较稳定,不被任何氧化剂氧化
C.甲烷分子中具有极性键
D.甲烷分子中四个C﹣H键是完全等价的键
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-10,下列叙述正确的是
=1×10-10,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合,所得混合溶液中水的电离得到促进
D.上述溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现某些金属离子如 Fe3+、Cu2+等对H2O2的分解也具有催化作用,为了比较 MnO2与 Fe3+和Cu2+的催化效果,某同学设计了如图甲、乙所示的实验。
请回答相关问题:
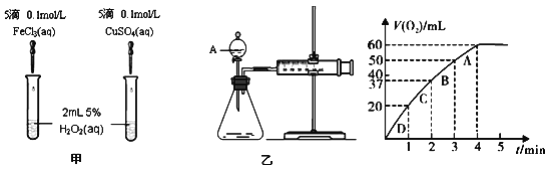
(1)定性分析:图甲可通过观察__________(填写相关实验现象), 定性比较得出结论。有同学提出将FeCl3 改为 Fe2(SO4)3 或者将 CuSO4 改为 CuCl2 更为合理,其理由是______________。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。检查乙装置气密性的方法是_____________,实验中需要测量的数据是___________。
(3)加入0.10mol MnO2 粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示.
①实验时放出气体的总体积是_______mL, 反应放出气体所需时间约为_________min。
②A、B、C、D各点反应速率快慢的顺序为 D>C>B>A.解释反应速率变化的原因:______________。
③计算 H2O2 的初始物质的量浓度为__________mol/L。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是一种重要的战略物资,以黄铜矿(主要成分是CuFeS2)为主要原料生产铜、铁红、单质硫时,原料的综合利用率较高,其主要流程如图所示(己知Na[CuCl2]的电离方程式为:Na[CuCl2]=Na++[CuCl2]-):
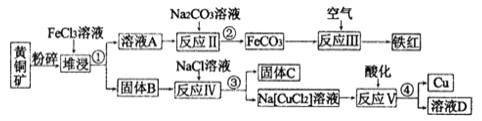
(1)流程中粉碎的目的是_____________,操作①、②、③、④的目的相同,在实验中这种操作的名称是____________。
(2)铁红的重要用途:__________________,固体B中含有两种产物,一种是单质C、另一种是原子个数比为1:l 的一种金属的低价态盐,写出堆浸时反应的化学方程式:________。
(3)反应V的离子方程式:___________________。
(4)此方法中得到的铜纯度不能满足某些生产的需要,需要利用电解法进行提纯。若用如图所示的装置进行电解精炼,则乙中溶液的溶质是_________,e电极上的电极反应式为_____。
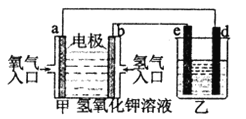
若当电路中有2mol电子通过时,乙中某个电极质量减轻了63.92g,则粗铜的纯度为(假设杂质只有铁且精炼时铜与铁的放电比例与混合物比例相同,计算时用%表示保留一位小数)____________(已知相对原子质量:Fe 56 Cu 64 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g) ![]() SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:
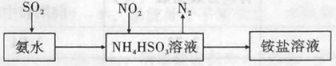
NO2被吸收的离子方程式是 。
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
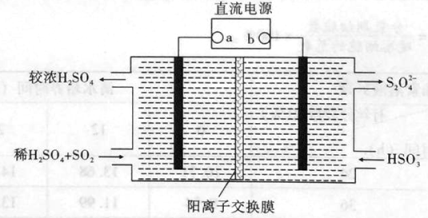
①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.1g平均相对分子质量为7.2的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
A.2.1g B.3.6g C.7.2g D.不可求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中常见的反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)某实验小组在实验室模拟上述反应。一定温度下,在2L盛有Fe2O3粉末的恒容密闭容器中通入0.1molCO,5min时生成2.24gFe。5min内有CO表示的平均反应速率是______________mol·L-1min-1;5min时CO2的体积分数为___________;若将此时反应体系中的混合气体通入100mL0.9mol/L的NaOH溶液中,充分反应后所得溶液中离子浓度由大到小的顺序是__________________ 。
(2)上述反应的平衡常数表达式为:K=_______________;下列能说明该反应已经达到平衡状态的是_____________(填序号)。
a.容器内固体质量保持不变
b.容器中气体压强保持不变
c.c(CO)=c(CO2)
d.v正(CO)=v逆(CO2)
(3)已知上述反应的平衡常数K与温度T(单位:K)之间的关系如图所示,其中直线的斜率为-![]() (气体常数R=8.3×10-3kJ·mol-1·K-1)。
(气体常数R=8.3×10-3kJ·mol-1·K-1)。
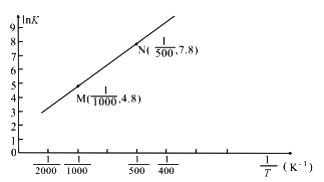
①根据图像可知,该反应的平衡常数随温度升高而____________(填“增大”、“减小”或“不变”)
②该反应的△H=_______________kJ·mol-1。
(4)结合上述有关信息,写出两条提高CO转化率的措施_____________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法没有体现“结构决定性质”的事实是
A. 丙烷的沸点比甲烷高
B. 金刚石比石墨更硬
C. 乙烯可以使溴水褪色,而乙烷不能
D. 金属钠比镁更活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届浙江省名校协作体高三下学期】
恒温恒容装置中发生如下反应:A(g)+2B(g)![]() 2C(g) ΔH = -a kJ·mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如下图所示。下列说法正确是
2C(g) ΔH = -a kJ·mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如下图所示。下列说法正确是
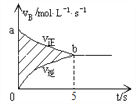
A. 反应放出的热量一定小于a kJ
B. 5s后,反应停止,各物质浓度保持不变
C. 5s末,ν(A)︰ν(B)=1︰2
D. 阴影部分面积可以表示A的物质的量浓度减少量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com