
【题目】W、X、Y、Z四种短周期元素在周期表中的相对位置如图所示。W、X、Y、Z原子的最外层电子数之和为21。下列说法中错误的是( )
![]()
A. 元素X的单质能与强酸、强碱反应B. 元素W、X与钠元素可形成化合物Na3XW6
C. 气态氢化物的稳定性:W>YD. 简单阴离子的还原性:W>Z
【答案】D
【解析】
由W、X、Y、Z四种短周期元素在周期表中的相对位置可知,W处于第二周期,X、Y、Z处于第三周期,设X的原子最外层电子数为a,则Y的最外层电子数是a+2,Z的最外层电子数是a+3,W的最外层电子数是a+4,W、X、Y、Z原子的最外层电子数之和为21,a+ a+2+ a+3+a+4=21,解得a=3,故X是Al,Y是P,Z是S,W是F。
A. X是Al,能与强酸和强碱反应,故A正确;
B. 元素W、X分别为F、Al,与钠元素可形成化合物Na3AlF6,故B正确;
C. 非金属性W>Y,故气态氢化物的稳定性:W>Y,故C正确;
D.非金属性Z<W,故简单阴离子的还原性:W<Z,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】下列各组物质中按氧化物、酸、碱顺序排列的是( )
A.水、硝酸、苛性钠B.氧化钠、小苏打、纯碱
C.小苏打、苏打、纯碱D.硫酸、氧化镁、氢氧化钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废弃物的资源化回收再利用,可以更大限度的发挥原材料的价值,以下是工业生产纳米磁性氧化铁的流程,下列说法不正确的是

A. 用Na2CO3溶液浸泡是为了除去废铁屑表面的铁锈
B. 加适量的H2O2是为了将部分Fe2+氧化为Fe3+
C. 若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品
D. 溶液A中Fe2+和Fe3+的浓度比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的钠、铝合金置于水中,合金全部溶解,得到20mL、pH=14的溶液。然后用1mol/L的盐酸滴定至沉淀量最大时,消耗盐酸40mL。原合金中钠的质量为( )
A. 0.92g B. 0.69g C. 0.64g D. 0.23g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸中二氧化硫的催化氧化原理为:2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是

A. 在A、B、C三点时,V(正)=v(逆),在D点时V(正)>v(逆)
B. A、B、C三点的平衡常数一定不相同
C. 升高温度可以加快化学反应速率,有利于平衡向正反应方向移动
D. 一定温度下,保持容器体积不变,向平衡体系中通人稀有气体,压强增大,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D 原子序数依次增加,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略)。下列说法正确的是

A. 原子半径大小顺序:D>C>B>A B. 最简单气态氢化物的稳定性:B>C
C. 图示转化关系涉及的反应均为氧化还原反应 D. 元素C、D形成的化合物中一定只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
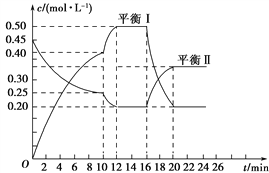
(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
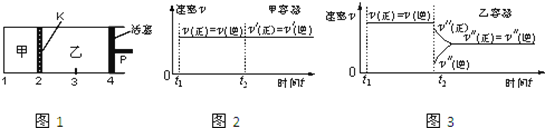
A. 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B. 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加
C. 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D. 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com