
| A. | ①②④⑤ | B. | ①⑤⑥ | C. | ①③④⑥ | D. | ②③④⑤ |
分析 ①根据纯净物和混合物的定义分析:纯净物中只含有一种物质,混合物中含有多种物质;
②煤、石油、天然气是常规的三大化石燃料,属于不可再生能源;
③水溶液中或熔融状态导电的化合物为电解质,电解质在水溶液中完全电离的是强电解质,部分电离的是弱电解质,水溶液中和熔融状态都不导电的化合物为非电解质;
④根据常见的合金铁合金、铜合金等分析,合金是不同金属融合在一起形成具有特征性质的混合物;
⑤水溶液中电离出的阳离子全部是氢离子的化合物为酸,水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱,金属阳离子和酸根阴离子构成的化合物为盐,纯碱不是碱而是显碱性的盐;
⑥分散质微粒直径在1-100nm的分散质溶于分散剂形成的混合物为胶体;
解答 解:①酸雨中含有亚硫酸和水等物质,属于混合物,碱石灰是氢氧化钠和氧化钙的混合物,故①正确;
②煤、石油、天然气是常规的三大化石燃料,属于不可再生能源,故天然气和水蒸气都是可再生能源,故②错误;
③蔗糖水溶液中和熔融状态都不导电属于非电解质,硫酸钡熔融状态全部电离属于强电解质,水部分电离属于弱电解质,故③正确;
④不锈钢是铁的合金,目前使用的硬币有铜镍合金和不锈钢,都属于合金,故④正确;
⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、盐、盐和氧化物,故⑤错误;
⑥豆浆和雾都是分散质在分散剂中形成的胶体分散系,故⑥正确,
故①③④⑥正确.
故选C.
点评 本题综合性的考查了与生活有关合金、酸雨、纯净物、混合物等多个知识点,难度不大,可依据化学知识和生活常识解答.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
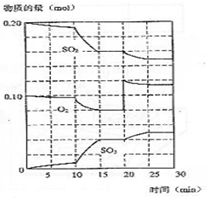 在一定条件下发生如下反应:2SO2(g)+O2 (g)?2SO3(g);△H<0
在一定条件下发生如下反应:2SO2(g)+O2 (g)?2SO3(g);△H<0查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
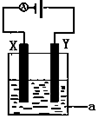
| A. | 钠块沉在乙醇液面下面 | B. | 钠块熔成小球 | ||
| C. | 钠块在乙醇液面上游动 | D. | 钠块表面无气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
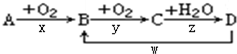
 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6 kJ/mol
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6 kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com