

分析 (1)亚硫酸酸性溶液弱于硫酸,依据强酸制备弱酸可知亚硫酸钠与浓硫酸反应生成二氧化硫和、硫酸钠;
(2)依据二氧化硫具有还原性,能够还原高锰酸钾;二氧化硫具有氧化性能够氧化硫离子解答;检验二氧化硫的还原性,应选择具有氧化性物质,能够与二氧化硫反应的物质;
(3)根据二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色来解答;
(4)二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应,被氢氧化钠溶液吸收.
解答 解:(1)亚硫酸钠与浓硫酸反应生成二氧化硫和、硫酸钠,化学方程式:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H20;
故答案为:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H20;
(2)二氧化硫具有还原性,能够还原高锰酸钾,使高锰酸钾褪色;二氧化硫具有氧化性能够氧化硫离子生成单质硫,溶液出现淡黄色沉淀;
A.浓硫酸与二氧化硫不反应,故A不选;
B.二氧化硫与氯化铁反应是氯化铁还原为二价铁离子,溶液颜色变浅,故B选;
C.二氧化硫与溴水发生氧化还原反应使溴水褪色,故C选;
D.二氧化硫与氯化钠溶液不反应,故D不选;
故答案为:KMnO4溶液溶液褪色、出现淡黄色沉淀;还原性、氧化性;b、c;
(3)因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,则操作为待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,观察到的现象为无色溶液恢复为红色,
故答案为:待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色;
(4)二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应,被氢氧化钠溶液吸收;
故答案为:NaOH.
点评 本题考查二氧化硫的制取及二氧化硫的性质实验,明确反应原理、二氧化硫的性质是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
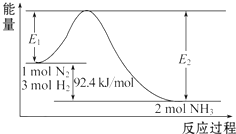 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2×10-7mol/Lmol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11mol/Lmol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2×10-7mol/Lmol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11mol/Lmol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①⑤⑥ | C. | ①③④⑥ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和稀硝酸都具有氧化性 | |
| B. | 浓硝酸与金属反应不产生氢气,而稀硝酸与金属反应可置换出氢气 | |
| C. | 因常温下铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中 | |
| D. | 硝酸与金属反应时,只表现出氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验小组为探究SO2的漂白性和还原性,设计了以下实验.
实验小组为探究SO2的漂白性和还原性,设计了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
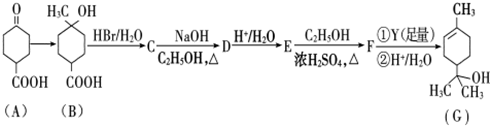
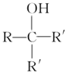
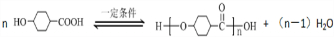 .
.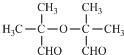 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
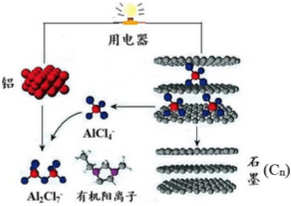 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 放电时,有机阳离子向铝电极方向移动 | |
| C. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- | |
| D. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com