
【题目】![]() 为周期表中前20号元素中的四种,原子序数依次增大,
为周期表中前20号元素中的四种,原子序数依次增大,![]() 为金属元素,
为金属元素,![]() 原子的最外层电子数是次外层电子数的3倍,
原子的最外层电子数是次外层电子数的3倍,![]() 位于同周期,
位于同周期,![]() 单质是一种良好的半导体.
单质是一种良好的半导体.![]() 能与冷水剧烈反应,
能与冷水剧烈反应,![]() 原子的最外层电子数之和与
原子的最外层电子数之和与![]() 原子的最外层电子数之和相等.下列说法正确的是
原子的最外层电子数之和相等.下列说法正确的是
A. 原子半径:![]() B. 气态氢化物的稳定性:
B. 气态氢化物的稳定性:![]()
C. 最高价氧化物对应水化物的碱性:![]() D.
D. ![]()
![]() 中共价键的数目为
中共价键的数目为![]()
【答案】A
【解析】
X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,X原子的最外层电子数是次外层电子数的3倍,则X有2个电子层,最外层电子数为6,故X为氧元素;Z单质是一种良好的半导体,Z为硅元素。W、Y为金属元素,且w原子序数大于还能和冷水反应,所以w为K,Y、Z位于同周期,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,故Y为铝元素,即X为氧元素,Y为铝元素,Z为硅元素,W为钾元素。
A.同周期随原子序数增大,原子半径减小,同主族自上而下,原子半径增大,所以原子半径,K![]() Al
Al ![]() Si
Si ![]() O即W>Y>Z>X,故A正确;
O即W>Y>Z>X,故A正确;
B.X为氧元素,Z为硅元素,同主族自上而下非金属性减弱,所以非金属性![]() ,非金属性越强,氢化物越稳定,所以气态氢化物稳定性X>Y,故B错误;.
,非金属性越强,氢化物越稳定,所以气态氢化物稳定性X>Y,故B错误;.
C.Y为铝元素,W为钾元素,同主族自上而下金属性增强,所以金属性![]() ,同周期自左而右金属性减弱,所以金属性
,同周期自左而右金属性减弱,所以金属性![]() ,金属性
,金属性![]() ,金属性越强,最高价氧化物对应水化物的碱性越强,所以碱性Y<W,故C错误;
,金属性越强,最高价氧化物对应水化物的碱性越强,所以碱性Y<W,故C错误;
D.SiO2是原子晶体,1个O原子周围有2个Si原子,1个Si原子周围有4个O原子,![]()
![]() 中共价键的数目为
中共价键的数目为![]() ,故D错误;
,故D错误;
本题答案为A。


科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧C、D的分子数之比为1∶1
A. ②③④⑤ B. ①③⑤⑦ C. ②③⑤⑦ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知很多气体都能用来做喷泉实验,若在同温同压下两个等体积烧瓶,一个收集满![]() 和
和![]() 的混合气体,另一个收集满
的混合气体,另一个收集满![]() ,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(
,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(![]() )和溶质的质量分数(
)和溶质的质量分数(![]() )关系是(两烧瓶所得溶液密度几乎相等)
)关系是(两烧瓶所得溶液密度几乎相等)
A. ![]() 和
和![]() 都不同 B.
都不同 B. ![]() 和
和![]() 都相同
都相同
C. ![]() 相同,
相同,![]() 不同 D.
不同 D. ![]() 相同,
相同,![]() 不同
不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
⑴ 将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) ΔH 1 = +489.0 kJ·mol-1
C(石墨) + CO2(g) =2CO(g) ΔH 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为___________________________________________。
⑵ 二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) ΔH
CH3OH(g) +H2O(g) ΔH
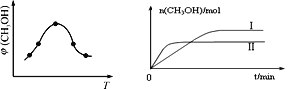
① 取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应ΔH_______0(填“>”、“<”或“=”)。
② 在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为:KⅠ______KⅡ(填“>” 或“<”)。
⑶ 以CO2为原料还可以合成多种物质。①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为_____________________________________。当氨碳比n(NH3 )/n(CO2 )=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com