
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���塣
�� ��CO2�뽹̿��������CO��CO�����������ȡ�
��֪��Fe2O3(s) + 3C(ʯī) = 2Fe(s) + 3CO(g) ��H 1 = +489.0 kJ��mol��1
C(ʯī) + CO2(g) =2CO(g) ��H 2 = +172.5 kJ��mol��1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ___________________________________________��
�� ������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H
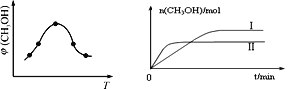
�� ȡһ�����CO2��H2�Ļ������(���ʵ���֮��Ϊ1��3)����������ܱ������У�����������Ӧ����Ӧ�����в�ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ��ͼ��ʾ����÷�Ӧ��H_______0(����>������<����������)��
�� �����ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ��ʾ������I�����Ӧ��ƽ�ⳣ����С��ϵΪ��K��______K��(����>�� ����<��)��
�� ��CO2Ϊԭ�ϻ����Ժϳɶ������ʡ��ٹ�ҵ������[CO(NH2)2]��CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ_____________________________________������̼��n(NH3 )/n(CO2 )��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ______��
���𰸡�Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ��H = ��28.5 kJ��mol��1 �� > 2NH3+CO2![]() CO(NH2)2+H2O 40%��0.4
CO(NH2)2+H2O 40%��0.4
��������
(1)��Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H1=+489.0kJmol-1
��C��ʯī��+CO2��g��=2CO��g����H2=+172.5kJmol-1
���ݸ�˹���ɢ�-����3�õ�Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-28.5 kJmol-1����ˣ�������ȷ���ǣ�Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-28.5 kJmol-1��
��2������ͼ����֪����ߵ㷴Ӧ����ƽ�⣬��ƽ����¶�Խ�ߣ��գ�CH3OH��ԽС��ƽ�����淴Ӧ���У������¶�ƽ�����ȷ�����У��淴ӦΪ���ȷ�Ӧ��������ӦΪ���ȷ�Ӧ������H��0����ˣ�������ȷ���ǣ�����
����ͼ�ж����ߢ��Ӧ�ķ�Ӧ��Ӧ���ʿ죬�¶ȸߣ��״����ʵ���С��KֵС����������I�����Ӧ��ƽ�ⳣ����С��ϵΪ��K��>K��;�𰸣�>��
��3�� ��CO2Ϊԭ�ϻ����Ժϳɶ������ʡ��ٹ�ҵ������[CO(NH2)2]��CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ2NH3+CO2![]() CO(NH2)2+H2O��
CO(NH2)2+H2O��
����̼��n(NH3 )/n(CO2 )��3����ƽ��ʱCO2��ת����Ϊ60%���ɷ�ӦΪ2NH 3+CO 2![]() CO(NH 2) 2+H 2O���谱�������ʵ���Ϊ3mol���������̼����Ϊ1mol����
CO(NH 2) 2+H 2O���谱�������ʵ���Ϊ3mol���������̼����Ϊ1mol����
2NH 3+ CO 2![]() CO(NH 2) 2+H 2O
CO(NH 2) 2+H 2O
ʼ����mol�� 3 1 0 0
ת���� ��mol�� 1.2 0.6 0.6 0.6
ƽ���� ��mol�� 1.8 0.4 0.6 0.6
��NH 3��ƽ��ת����Ϊ1.2��3![]() =40
=40![]() ���𰸣�2NH 3+CO 2
���𰸣�2NH 3+CO 2![]() CO(NH 2) 2+H 2O ��40
CO(NH 2) 2+H 2O ��40![]() ��
��


 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() Ϊ���ڱ���ǰ20��Ԫ���е����֣�ԭ��������������
Ϊ���ڱ���ǰ20��Ԫ���е����֣�ԭ��������������![]() Ϊ����Ԫ�أ�
Ϊ����Ԫ�أ�![]() ԭ�ӵ������������Ǵ�����������3����
ԭ�ӵ������������Ǵ�����������3����![]() λ��ͬ���ڣ�
λ��ͬ���ڣ�![]() ������һ�����õİ뵼�壮
������һ�����õİ뵼�壮![]() ������ˮ���ҷ�Ӧ��
������ˮ���ҷ�Ӧ��![]() ԭ�ӵ�����������֮����
ԭ�ӵ�����������֮����![]() ԭ�ӵ�����������֮����ȣ�����˵����ȷ����
ԭ�ӵ�����������֮����ȣ�����˵����ȷ����
A. ԭ�Ӱ뾶��![]() B. ��̬�⻯����ȶ��ԣ�
B. ��̬�⻯����ȶ��ԣ�![]()
C. ����������Ӧˮ����ļ��ԣ�![]() D.
D. ![]()
![]() �й��ۼ�����ĿΪ
�й��ۼ�����ĿΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С���о���������������ʱ���ı�ijһ�����Ի�ѧƽ���Ӱ�죬�õ����±仯����(ͼ��p��ʾѹǿ��T��ʾ�¶ȣ�n��ʾ���ʵ���)��


�������Ϲ����жϣ����н�����ȷ����(����)
A. ��Ӧ������H>0��p2>p1
B. ��Ӧ������H<0��T1>T2
C. ��Ӧ������H>0��T2>T1������H<0��T2<T1
D. ��Ӧ������H<0��T2>T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����º�ѹ�£���һ���ݻ��ɱ���ܱ������з�����Ӧ��A(g)��B(g)![]() C(g)������ʼʱͨ��1molA��1molB���ﵽƽ��ʱ����amolC��������˵���������( )
C(g)������ʼʱͨ��1molA��1molB���ﵽƽ��ʱ����amolC��������˵���������( )
A. ����ʼʱͨ��3molA��3molB���ﵽƽ��ʱ�����ɵ�C�����ʵ���Ϊ3amol
B. ����ʼʱͨ��4molA��4molB��2molC���ﵽƽ��ʱ��B�����ʵ���һ������4mol
C. ����ʼʱͨ��2molA��2molB��1molC���ﵽƽ��ʱ����ͨ��3molC�����ٴδﵽƽ���C�����ʵ�������Ϊa/(2-a)
D. ����ԭƽ����ϵ�У���ͨ��1molA��1molB����������ƽ����Է�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����M��SO42����Mg2����Na���������������ʵ���֮��Ϊ2��4��1��2��ͬ������ͬһ����Һ�У���ôM������
A. Ba2+ B. CO32�� C. Cu2+ D. Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ����ˮ�Ȳ����������ֲ�����ԭ������
A.SO3+H2O��H2SO4B.Cl2+H2O��HCl+HClO
C.2F2+2H2O��4HF+O2D.2Na+2H2O��2NaOH+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ϱ��и����ĵ���ƽ�ⳣ���ش��������⣺
���� | CH3COOH | HNO2 | HCN | HClO |
����ƽ�ⳣ��(Ka��Kb) | 1.8��10-5 | 4.6��10-4 | 5��10-10 | 3��10-8 |
�������������У�������������ǿ����ֱ���_______��_______���û�ѧʽ��ʾ����
��������ʹ������Һ��CH3COOH�ĵ���̶���������ƽ�ⳣ������IJ�����____������ţ���
A.�����¶� B.��ˮϡ�� C����������CH3COONa����
D�������������� E�����������ƹ���
�����ϱ������жϴ���ʹ���������Һ�ܷ�Ӧ��������ܷ�Ӧ˵�����ɣ�����ܷ�����Ӧ��д����Ӧ�����ӷ���ʽ___________________________________��
(2) ijѧϰС����������KMnO4��H2C2O4��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족�� ʵ��ʱ���ȷֱ���ȡKMnO4������Һ��H2C2O4��Һ��Ȼ������Թ���Ѹ����Ͼ��ȣ���ʼ��ʱ��ͨ���ⶨ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�����
����֪����H2C2O4��һ�ֶ�Ԫ���ᣬд������ĵ��뷽��ʽ__________��___________������KMnO4��Һ��H2C2O4��Һ��Ӧ�����ӷ���ʽΪ��_____________________________
ijͬѧ���������ʵ��
ʵ���� | H2C2O4��Һ | KMnO4��Һ | �¶�/�� | ||
Ũ�ȣ�mol/L�� | �����mL�� | Ũ�ȣ�mol/L�� | �����mL�� | ||
a | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
b | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
c | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
��̽��Ũ�ȶԻ�ѧ��Ӧ����Ӱ������ʵ������__________����̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������__________��
��ʵ��a��û�Ϻ���Һ��ɫ��ʱ��Ϊ40 s�����Ի��ǰ�������С�仯�������ʱ���ڵ�ƽ����Ӧ����v(KMnO4)=______ mol��L��1��min��1��
����ʵ���У�����(H2C2O4)��Һ��KMnO4������Һ��Ӧʱ����ɫ����������죬����ܵ�ԭ����___________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���1 mol A(g)��1 mol B(g)����2 L�ܱ������з�����ӦA(g)+B(g)xC(g)+D(s)����t1ʱ�ﵽƽ�⡣��t2��t3ʱ�̷ֱ�ı䷴Ӧ��һ�����������������C(g)��Ũ����ʱ��仯��ͼ��ʾ�������й�˵����ȷ����

A. ��Ӧ����ʽ��x��2
B. t2ʱ�̸ı��������ʹ�ô���
C. t3ʱ�̸ı����������ȥ����D
D. t1��t3��÷�Ӧ��ƽ�ⳣ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
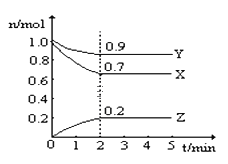
��1���÷�Ӧ�Ļ�ѧ����ʽΪ _______________________��
��2���ӿ�ʼ��2min��Z��ƽ����Ӧ����Ϊ ___________��
��3��ij̽����ѧϰС������ͬ������п����ͬŨ�ȵ�������ϡ���ᷴӦ�õ�ʵ���������±���ʾ��
ʵ���� | п��״̬ | ��Ӧ�¶�/�� | �ռ�100mL��������ʱ��/s |
�� | ��Ƭ | 15 | 200 |
�� | ��Ƭ | 25 | 90 |
�� | ��ĩ | 25 | 10 |
�ٸ�ʵ���Ŀ����̽�� ______ �� ______ ��п��ϡ���ᷴӦ���ʵ�Ӱ�죻
��ʵ���͢���� ________________________________ ����ѧ��Ӧ����Խ��
���ܱ�������ı�����Է�Ӧ������Ӱ���ʵ������ ______ �� ______��
�������һ��ʵ�鷽��֤�������Ũ�ȶԸ÷�Ӧ�����ʵ�Ӱ�죺 ______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com